


正文
130多年前,德国生物学家阿尔布雷希特·科塞尔首次从茶叶中提取茶碱。茶碱(theophylline,TEP)作为一种支气管扩张剂,能扩张支气管平滑肌、降低气道反应性并具有抗炎作用,在临床上用于治疗慢性阻塞性肺疾病、哮喘和婴儿呼吸暂停等呼吸系统疾病。然而,其治疗浓度窗口较窄,需严格监测浓度,以免高浓度引发严重不良反应。茶碱特异性适体(如短单链DNA或RNA)以高特异性、低成本及低免疫原性的优势,可作为茶碱的生物传感器用于浓度检测。特异性识别茶碱的RNA适体于1994年由Jenison等人发现,其配体结合机制已被阐明,茶碱DNA适体于2022年由刘珏文团队开发,其能特异性识别并结合茶碱而不结合咖啡因,这两个小分子仅有一个甲基的区别。同时其对茶碱的亲和力明显优于3-甲基黄嘌呤(3-methylxanthine,3-M)和次黄嘌呤(hypoxanthine,HPA),目前,其结构尚未解析,配体识别机制仍不明。
核酸适体主要通过指数富集的配体系统进化(Systematic Evolution of Ligands by Exponential Enrichment,SELEX)筛选获得,但其实验周期长、操作复杂且特异性难以保证,成本效益限制了其大规模应用。近年来,多个研究小组成功利用天然核糖体开关或核酶作为支架,筛选有效新适体,但仍未完全克服传统SELEX实验的局限。
茶碱DNA适体整体上呈现茎环结构,包含两个茎(P1、P2)和一个配体结合口袋区,配体结合口袋区由两个连接区J1/2和J2/1组成,表面视图展示单一的半封闭的配体结合口袋结构(图1)。5个脱氧核苷酸(G1到T5)形成了P1茎的第一条链。然后,该链延伸到第一个连接区(J1/2),该连接区(G6到C9)形成配体结合口袋区域的第一条链。之后,DNA链通过向下伸展的碱基(T10)延伸到P2,该碱基是闭合结合袋的关键核苷酸。A11和T12形成了P2的第一条链。随后,它与两个脱氧核苷酸(T13和C14)形成一个茎环,然后向下弯曲形成P2的第二条链(A15和T16)。继续向下,DNA链进入第二个连接区(J2/1),呈现S-turn结构,同时形成配体结合口袋区的第二和第三链(A17到C24,其中A17-G19属于第二链,G21-C24属于第三链)。最后,DNA链完成了P1茎的第二条链(G25到C29)。整体结构的表面视图展示了一个单一的半封闭的配体结合口袋。
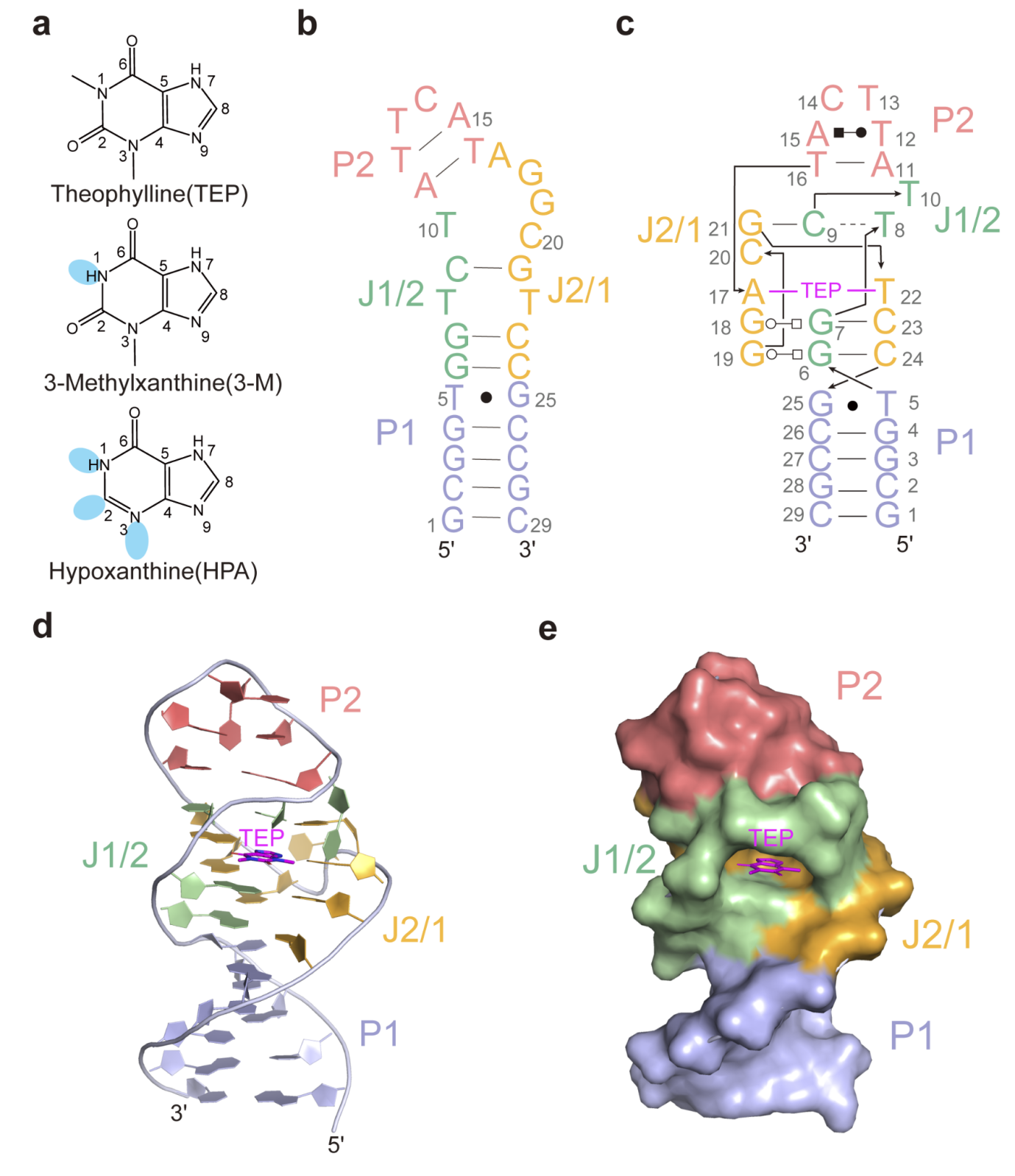
图1. 茶碱DNA适体的整体结构
茶碱DNA适体核心区域为其配体结合口袋区域,位于P1和P2之间,如图2a所示。该区域始于P1的G25•T5碱基对,由四个三碱基相互作用平面组成,每个平面都有广泛的氢键相互作用,其中第三个平面是配体结合位点。第一个三碱基相互作用平面涉及G19-(trans Watson–Crick–Hoogsteen)-G6-(cis Watson–Crick)-C24(图2b),第二个三碱基相互作用平面G18:G7:C23与第一个类似(图2c)。配体结合位点内的小分子与A17和T22形成氢键,在第二和第四个三碱基相互作用平面之间形成一个中间面板。第四层三碱基相互作用平面包括一个从C9 N4到T8 O2的氢键和一个C9-(cis Watson–Crick)-G21的碱基对(图2d)。
在茶碱DNA适体分别结合TEP、3-M和HPA的结构中,每个化合物的嘌呤环与A17的嘌呤环和T22的嘧啶环共面对齐,同时形成氢键。在结合TEP的结构中,嘌呤环的O6和N9接受A17 N6和T22 N3的氢键,而N7向A17 N1提供一个氢键(图2e)。正是由于N7位置的甲基取代,该甲基破坏了与A17 N1的氢键相互作用导致该适体无法识别和结合咖啡因。在结合3-M的结构中,与A17和T22可以观察到一致的氢键相互作用(图2f)。尽管HPA的亲和力比TEP低2000倍,但作者成功地解析了与HPA结合的茶碱DNA适体的晶体结构,HPA嘌呤环的N1向A17 N1提供一个氢键,而N3和O6分别接受T22 N3和A17 N6的氢键(图2g)。
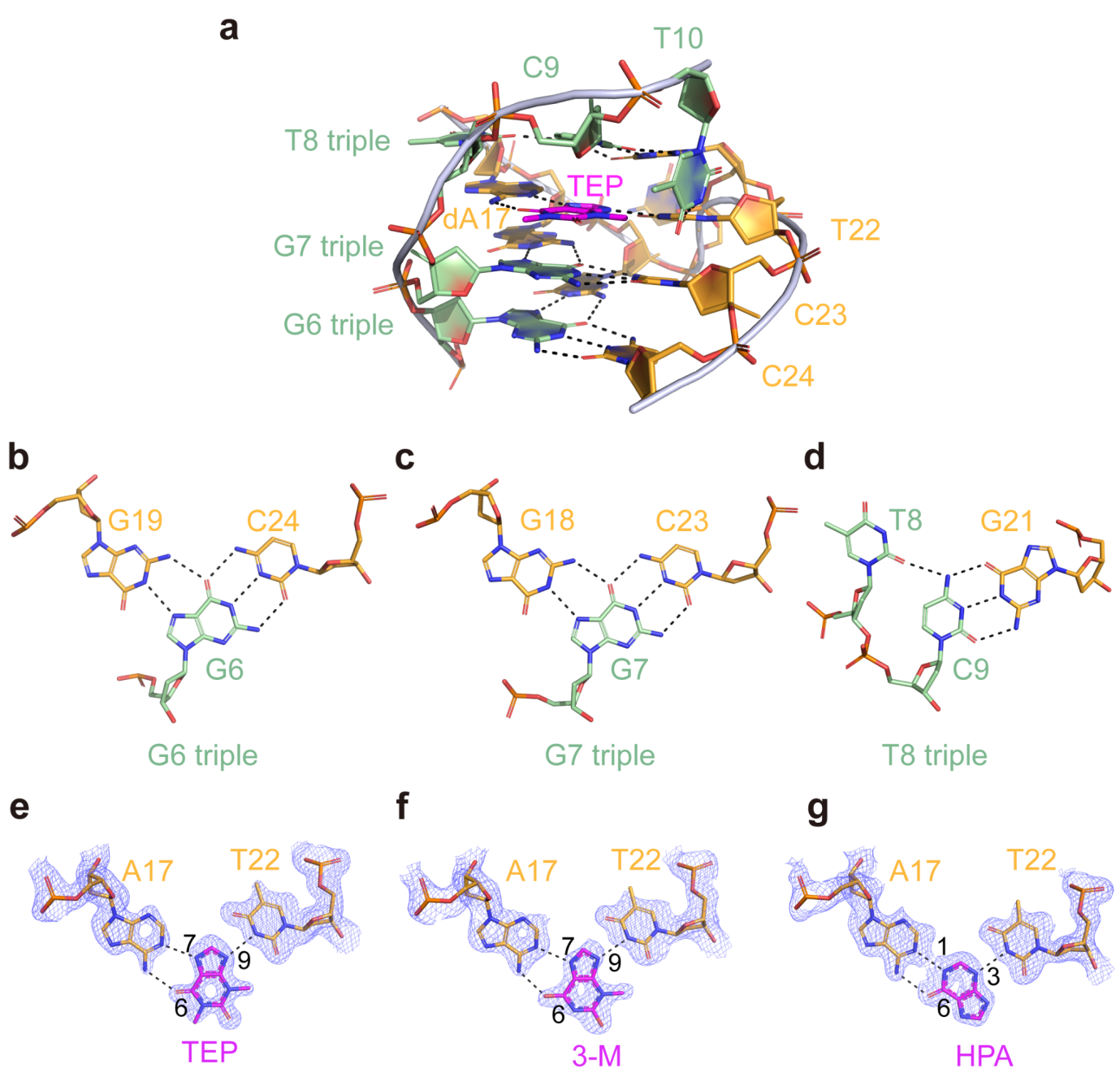
图2. 茶碱DNA适体的配体结合口袋结构和配体识别结合
作者通过生化实验电泳迁移率变化分析(Electrophoretic Mobility Shift Assay,EMSA)和等温滴定量热法(Isothermal Titration Calorimetry,ITC)验证了茶碱DNA适体配体识别结合机制(图3)。基于结构分析设计的特定碱基突变(A17G、T22C和A17G+T22C)破坏了适体与茶碱的氢键形成导致适体无法结合茶碱,进一步验证了晶体结构中观察到的氢键相互作用的正确性。
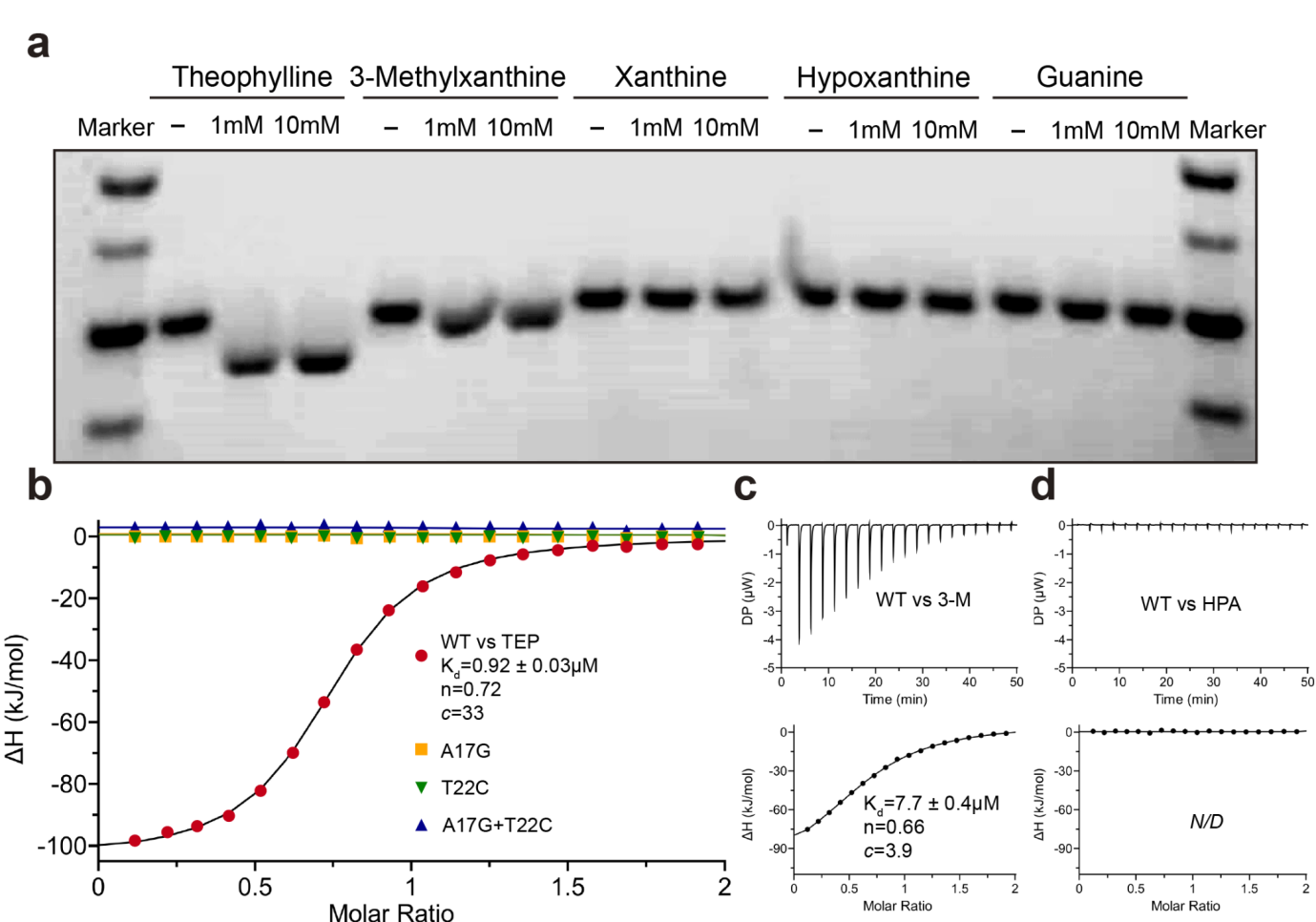
图3. 新适体开发策略和生化验证
基于上述配体结合机制,作者提出了一个合理设计的靶向茶碱类似物的适体开发策略。配体结合袋由四个平面结构域组成,并通过核苷酸A17和T22的氢键相互作用来稳定。作者假设,配体相互作用的碱基(A17和T22)的定向突变可以在保留整体拓扑结构的同时,可以形成特异性识别茶碱类似物的新适体(图4a)。为了验证这一假设,文章作者在这两个位置进行了系统突变(合计15个变异,不包括野生型),并使用Glide XP进行了分子对接模拟,以预测与15个茶碱类似物的结合亲和力。值得注意的是,preQ1和腺嘌呤作为配体出现,并可能与特定的突变体结合。突变体DNA-C-T对preQ1表现出最佳的对接分数,超过了野生型(DNA-A-T)和DNA-C-C。此外,突变体DNA-T-T对腺嘌呤表现出优越的亲和力,突变体DNA-C-T次之(图4b)。这些计算预测结果通过ITC实验进行了验证。对于preQ1,DNA-C-T表现出强结合(Kd = 1.3 μM),而野生型表现出中等亲和力(Kd = 9.0 μM),其他突变体表现出弱结合或无结合(图4c)。DNA-C-T是目前第一个报道的preQ1 DNA适配体。同样,DNA-T-T对腺嘌呤具有中等亲和力(Kd = 57 μM),与野生型弱结合(Kd = 203 μM)形成鲜明对比,在其他突变体中相互作用可以忽略(图4d)。通过ITC进行的特异性分析显示了独特的配体识别:DNA-C-T选择性识别结合preQ1,而不结合其类似物(TEP、3-M、HPA、GMP/GDP/GTP,图4e),同样DNA-T-T特异性识别结合腺嘌呤,而不结合其类似物(TEP、3-M、HPA、AMP/ADP/ATP,图4f),这种特异性与计算预测相一致。
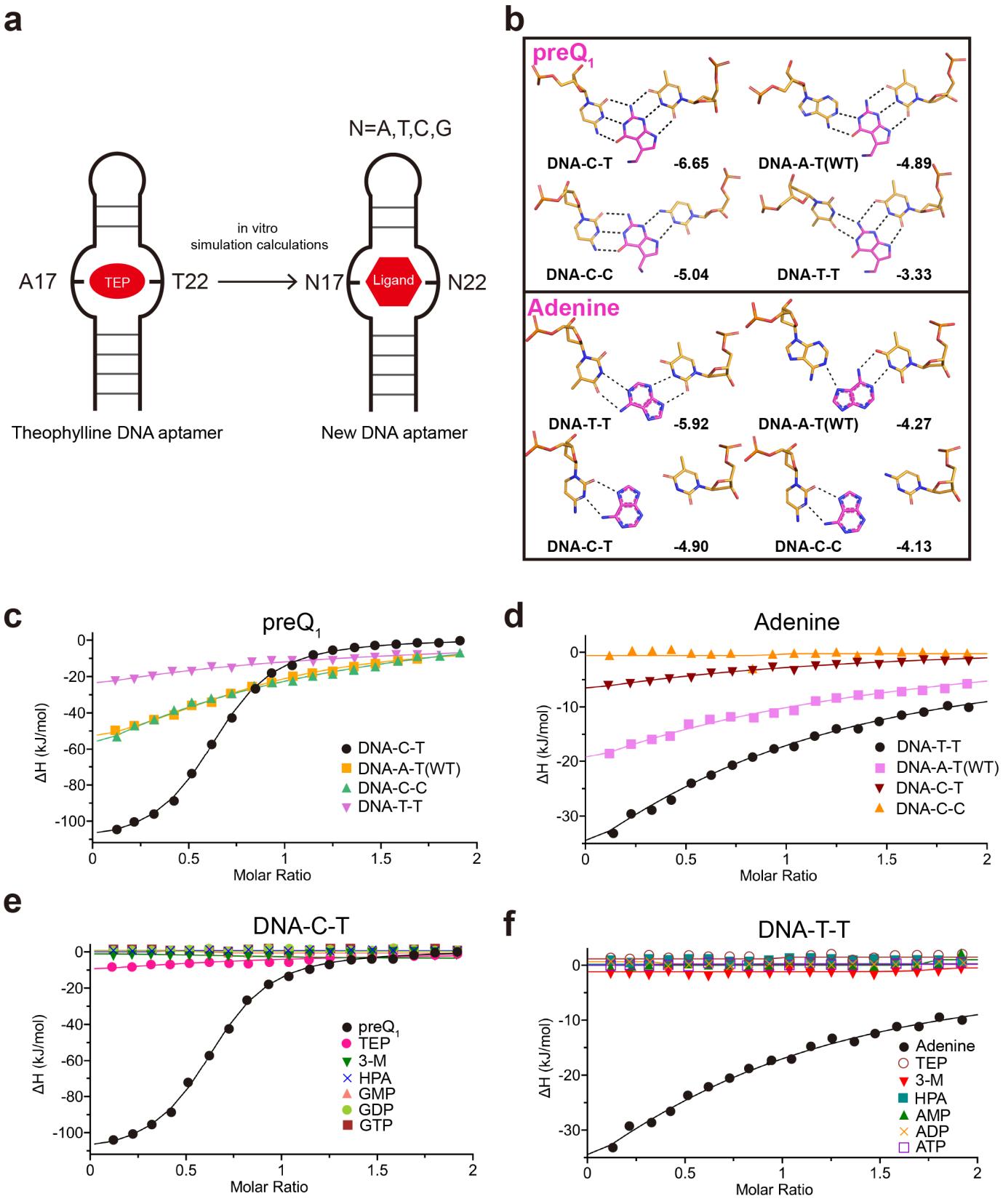
图4. 新适体开发策略和生化验证
作者同时也解析了DNA-T-T结合腺嘌呤的晶体结构,腺嘌呤结合模式与计算模拟预测的结合模式一致,表明开发适体的靶向突变策略是成功的。腺嘌呤适体的整体结构包括三个茎(P1、P2和P3)和两个与腺嘌呤结合的核心区域,根据虚线可以分为具有镜像对称的两部分。每个核心区域包含一个腺嘌呤结合位点(图5a,b)。该结构的各个部分显示了一个与茶碱适体一致的配体结合核心区域(图5c,d)。腺嘌呤在第三平面上形成广泛的氢键相互作用,嘌呤环的N1和N3接受T17 N3和T22 N3的氢键,而N6和N9分别向T17 O4和T22 O2提供氢键(图5e)。
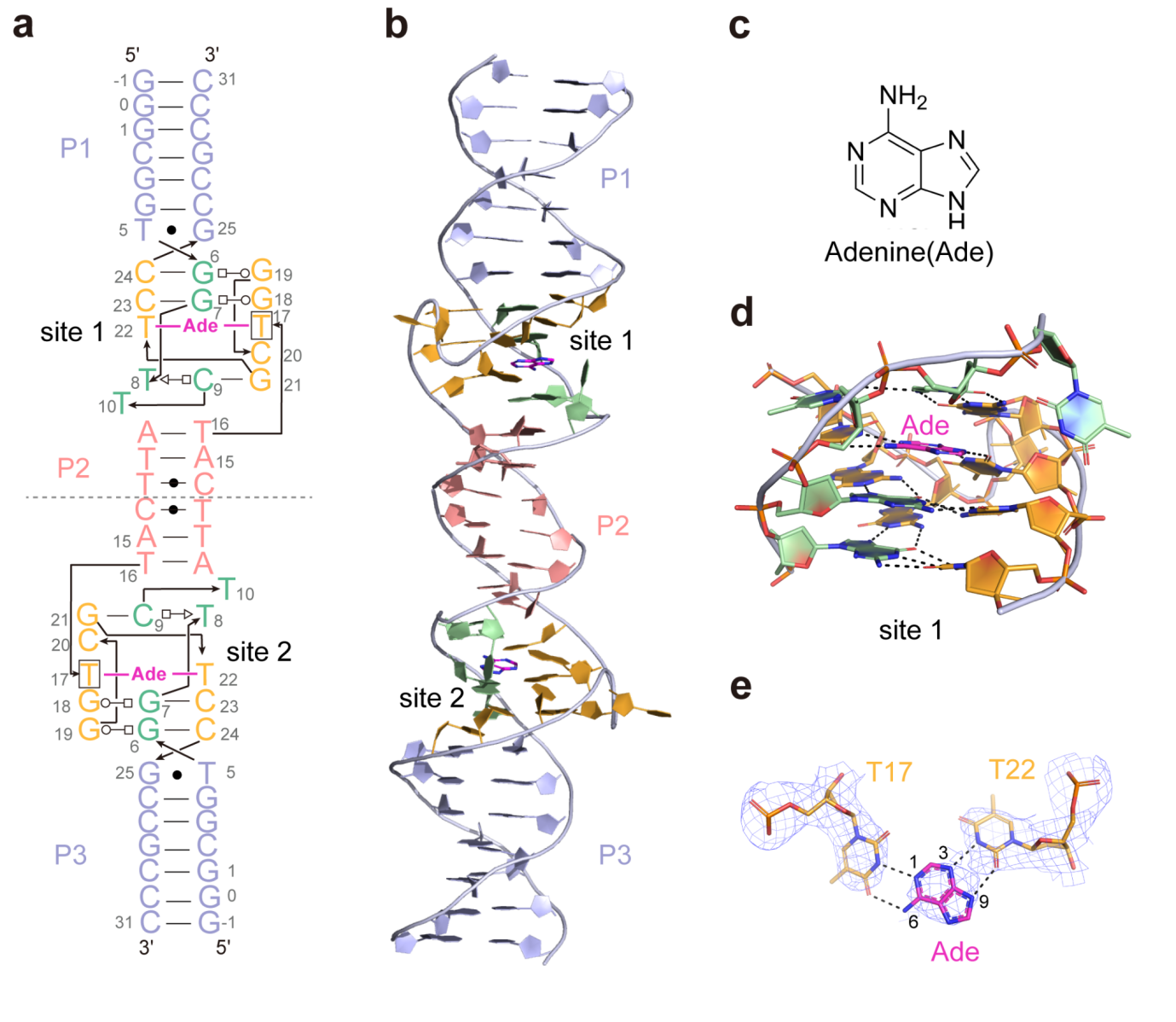
图5. 所设计的腺嘌呤DNA适体的结构验证
总结
中山大学孙逸仙纪念医院林晓伟、黄园尹和中山大学药学院黄锦超为论文共同第一作者。中山大学孙逸仙纪念医院黄林研究员与黄健教授、广州实验室苗智超研究员和中山大学药学院陈硕斌教授为论文共同通讯作者。
通讯作者介绍
本团队正在招聘博士后若干名,要求是已获得(或即将获得)生物学或医学尤其是适配体筛选与应用、酶学、微生物学、分子生物学或结构生物学研究方向的博士学位。感兴趣的申请人可将个人的完整简历(如果有论文发表,请附全文)以及其它相关资料以PDF格式发送至huanglin36@mail.sysu.edu.cn.
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn