

(图片来源:J. Am. Chem. Soc.)
正文
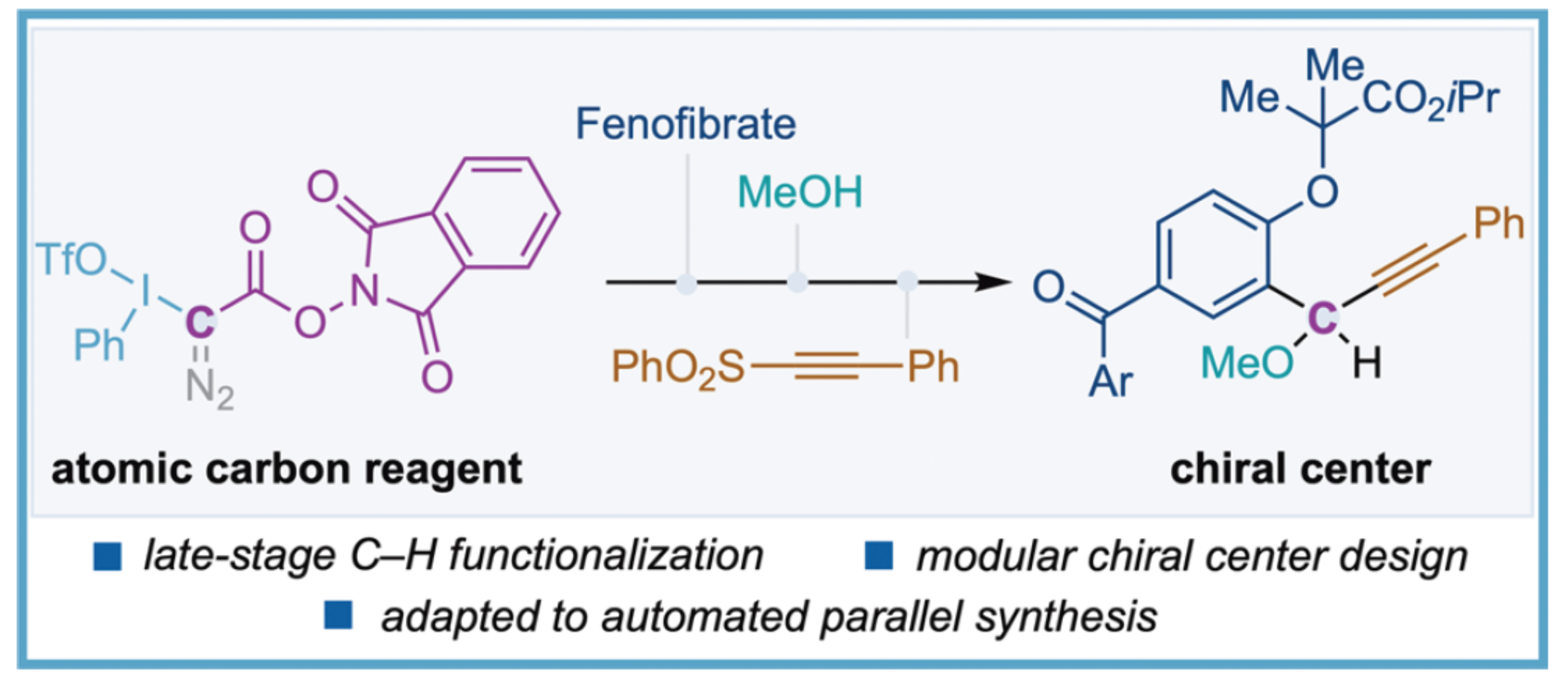
原子碳(亦称“naked”碳,:Ċ·)是一种基态为三重态的高反应活性物种,可通过特定核反应生成(Figure 1A)。现有原子碳的替代性制备方法包括:(i)高温(>2000°C)碳电弧法;(ii)二氧化三碳或叠氮化氰在紫外辐照下的光分解法;(iii)quadricyclanone或四唑衍生物制备的特定重氮化合物的热分解法(Figure 1A)。此类方法虽能研究游离原子碳对有机分子的反应活性,并证实其固有的形成四个新化学键的能力,但因反应过程高度放热、非选择性、需高温条件或涉及爆炸性试剂,从而导致其实际合成应用价值有限。生成游离原子碳的替代策略是采用可在有机分子反应中模拟其功能的试剂(Figure 1B)。特定类型的钨磷叶立德或铬卡宾配合物通过烯烃的双环丙烷化反应,成功构建了螺[2.2]戊烷结构。最新研究进一步表明,NHC卡宾可作为原子碳直接转移试剂,可实现α,β-不饱和酰胺的环化反应。此外,近期报道的新型重氮化合物(Ph3P=C=N2)可实现乙烯叉中间体R₂C=C(:)向炔烃或丁三烯类化合物的转化。另一方面,基于活化设计试剂的原子碳转移策略,也是另一种有效的方法。在倍半萜Ishwarane合成的关键步骤中,四溴化碳(CBr₄)与甲基锂(MeLi)协同作用,通过两次连续的卡宾中间体(均源自α-消除反应)实现原子碳转移:首个卡宾引发环丙烷化反应,第二个则完成C-H键插入。二氯二硼甲烷试剂已被证实可通过有机金属亲核体与亲电体的协同作用能够高效构建手性中心。此外,一种氯原子与活化酯双取代的重氮化合物通过扩环反应实现了吲哚向喹啉的转化。然而,利用原子碳或其等价体通过芳基C-H键直接构建手性中心的合成方法,仍有待开发。近日,西班牙加泰罗尼亚化学研究所Marcos G. Suero课题组报道了一种新型原子碳试剂,其通过选择性活化高价碘、重氮基与氧化还原活性酯离去基团,成功实现了芳基C-H键的后期模块化手性中心构建(Figure 1C)。欢迎下载化学加APP到手机桌面,合成化学产业资源聚合服务平台。
(图片来源:J. Am. Chem. Soc.)
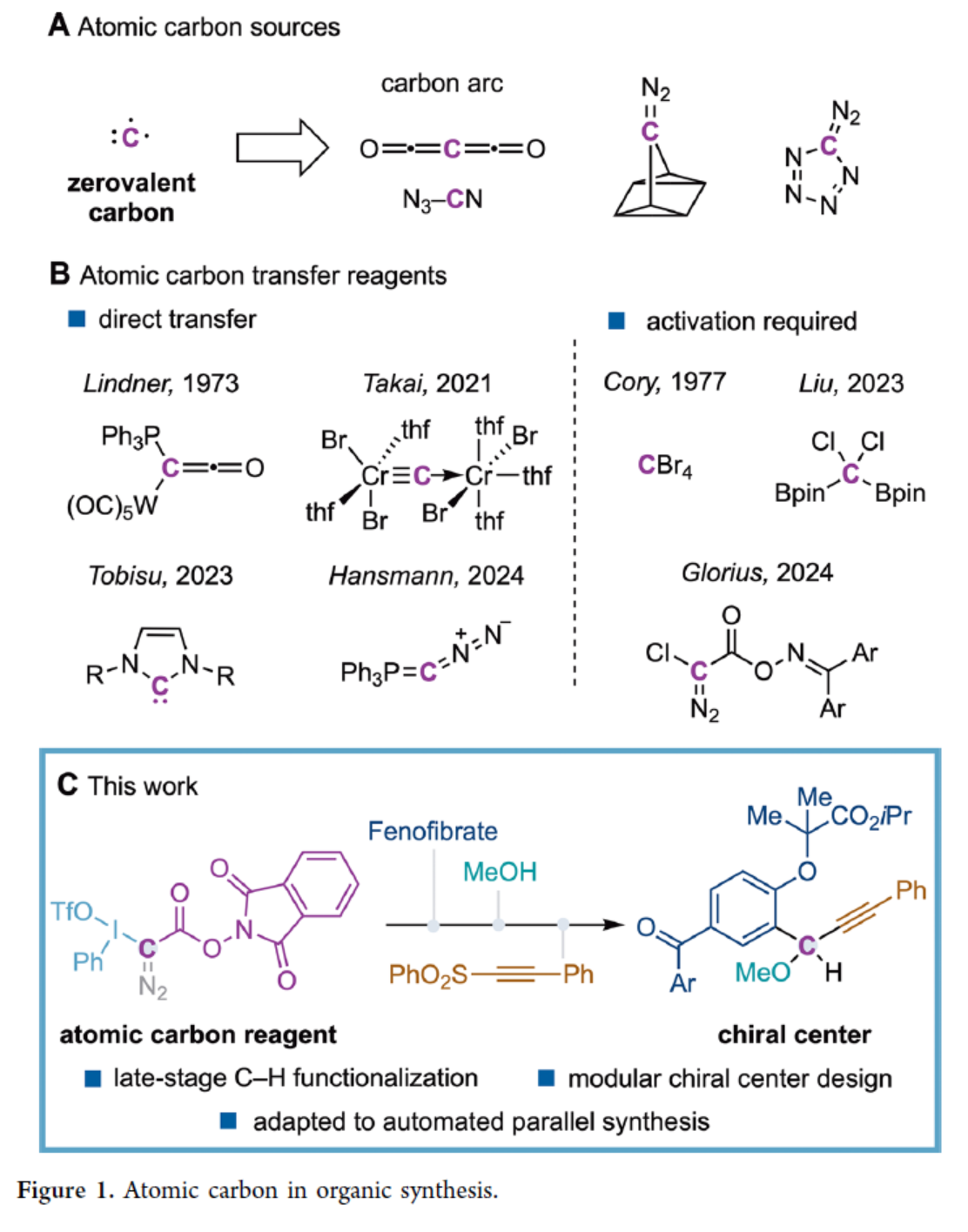
基于前期相关研究的总结,作者以N-羟基邻苯二甲酰重氮乙酸酯(1a)与碘苯二乙酸(2a)作为底物,三氟甲磺酸三甲基硅酯(TMSOTf)作为Lewis酸,二氯甲烷作为溶剂,在室温下反应,可以91%的收率得到原子碳试剂3a(Figure 2A)。同时,当碘苯二乙酸中的芳基上含有3-CF3或4-CH3以及重氮酯中的X为-Cl时,均可以良好的收率获得相应的原子碳试剂3b-3d。
其次,作者还对上述过程的反应机理进行了研究。Stern-Volmer研究结果表明,*[Ru(bpy)3]2+具有很强的荧光淬灭能力。CV实验结果表明,[Ru(bpy)3]2+催化剂在热力学上更倾向进行单电子转移过程。基于上述的研究,作者提出了一种合理的反应机理(Figure 2B)。试剂3a通过氧化淬灭*[Ru(bpy)3]2+的光氧化还原催化循环过程,生成重氮甲基自由基int-I。中间体int-I与芳香族化合物经自由基加成后,生成中间体int-II。随后,在[Ru(bpy)3]3+的单电子氧化作用下,经质子消除生成氧化还原活性芳基重氮乙酸酯5。
(图片来源:J. Am. Chem. Soc.)
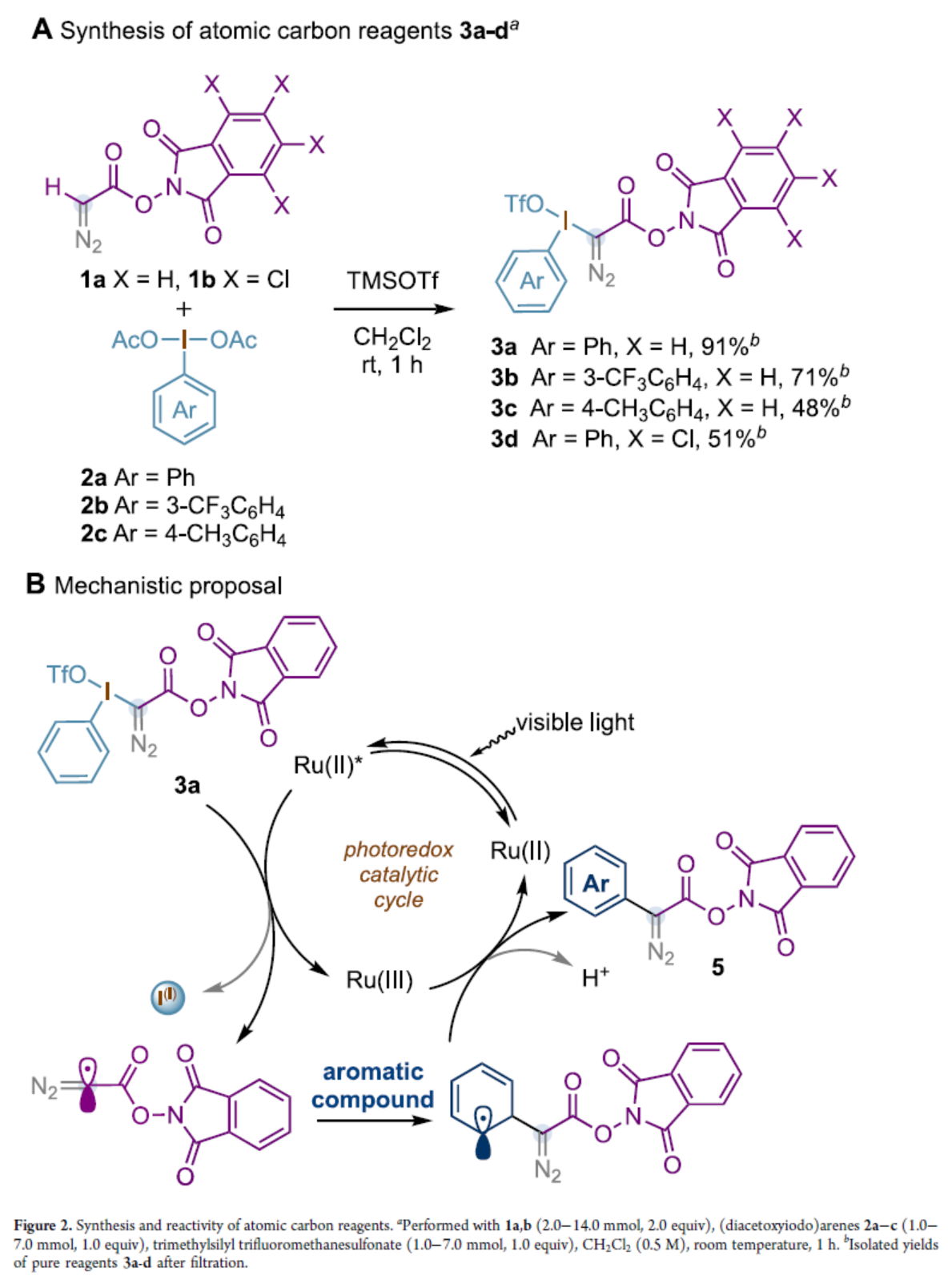
紧接着,作者以碳试剂3a与二甲苯4a作为模型底物,进行了相关反应条件的筛选(Table 1)。当以Ru(bpy)3(PF6)2(1 mol %)作为催化剂,NaHCO3(3.0 equiv)作为碱,白色LEDs作为光源,在MeCN溶剂中室温反应,可以82%的分离收率得到产物5a。
(图片来源:J. Am. Chem. Soc.)
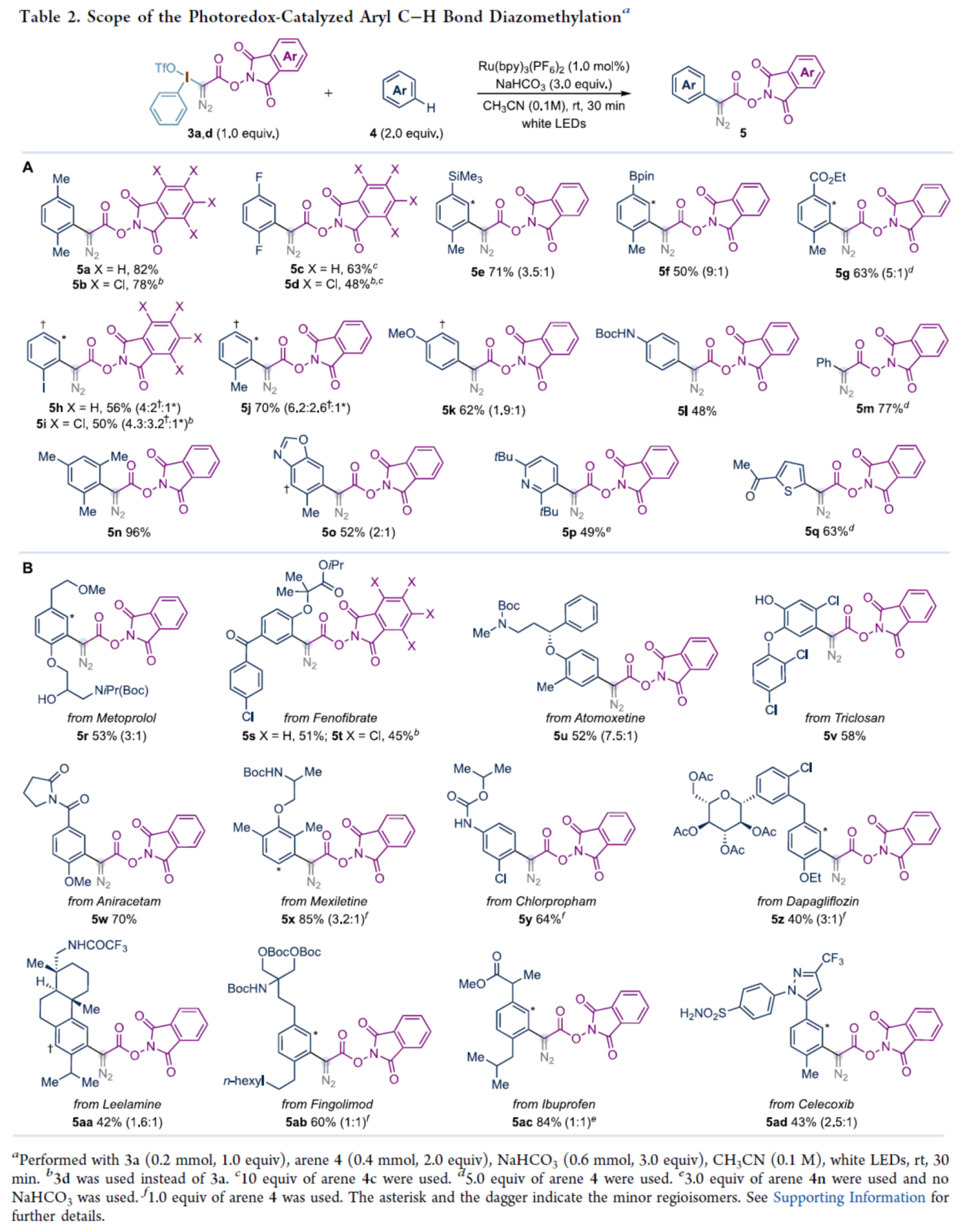
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Table 2)。首先,一系列二取代的芳烃,优先在位受阻较少与电子丰富的位点进行反应,获得相应的产物5a-5g,收率为48-82%。然而,对于碘苯(5h与5i)和甲苯(5j),在邻位的选择性较低,而苯甲醚(5k)和Boc-苯胺(5l)则在对位具有选择性。其次,苯、三取代芳烃以及含有氮/氧/硫杂环取代的芳烃,也与体系兼容,获得相应的产物5m-5q,收率为49-96%。此外,该策略还可用于一些药物分子的后期衍生化,获得相应的产物5r-5z和5aa-5ad,收率为40-85%。
(图片来源:J. Am. Chem. Soc.)
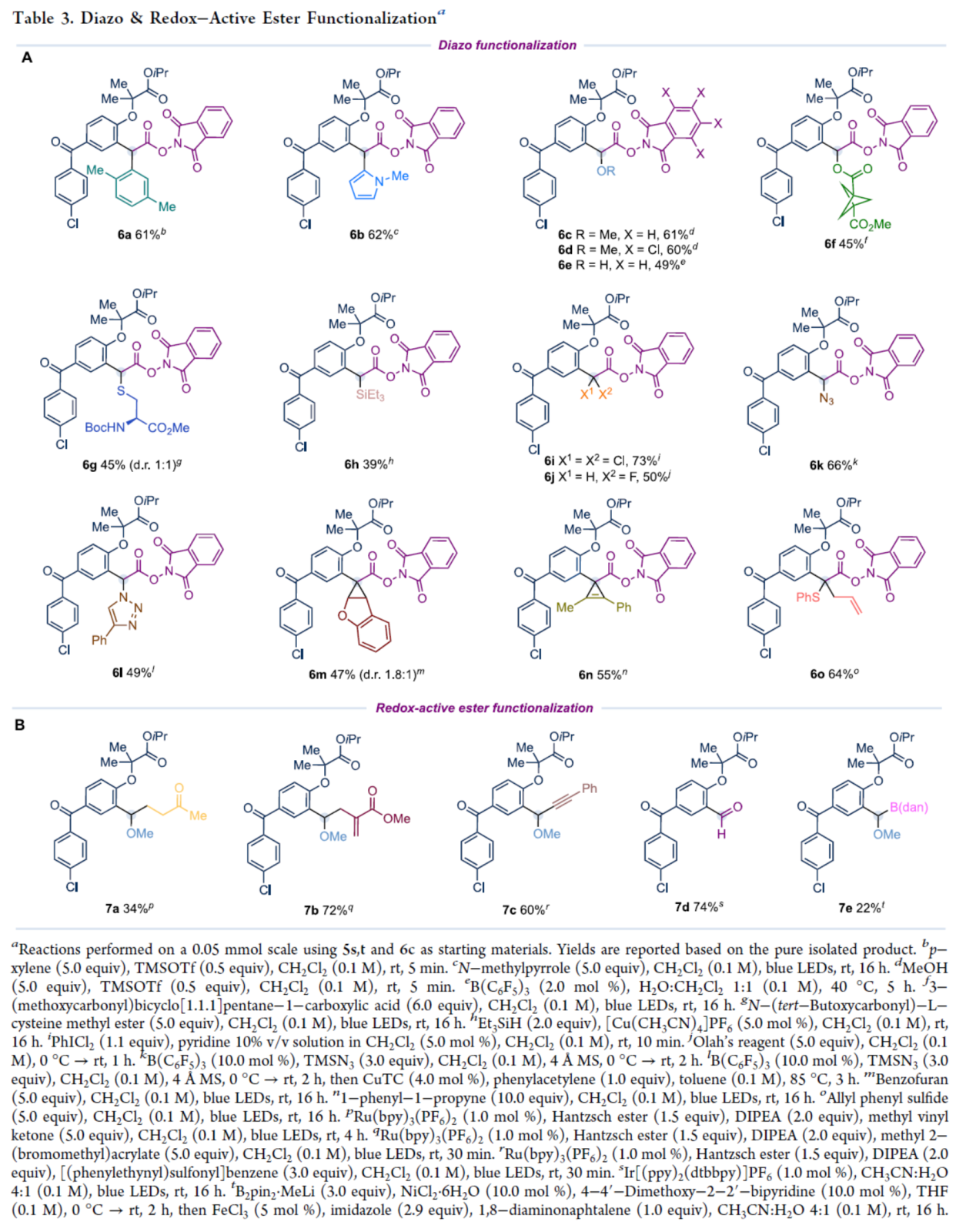
随后,作者对官能团化的重氮化合物和氧化还原活性酯的底物范围进行了扩展(Table 3)。首先,当重氮化合物中含有芳烃、杂环烃、醚、羟基、烷氧羰基、硫醚等时,均可顺利进行反应,获得相应的产物6a-6g,收率为39-62%。尽管Si-H插入在这些条件下不起作用,但在铜(I)催化下可成功进行反应,如6h。含有二氯化、氢氟化和氢叠氮化衍生的重氮化合物,也是合适的底物,获得相应的产物6i-6k,收率为50-73%。同时,一锅法的点击反应也能够顺利进行,如6l。其次,在蓝光照射生成的相应游离卡宾可以参与杂环的环丙烷化反应(6m)、炔烃的环丙烷化反应(6n)以及与烯丙基硫醚进行的Doyle−Kirmse反应(6o)。此外,以Ru(bpy)₃(PF₆)₂作为光催化剂,Hantzsch酯/DIPEA为牺牲还原剂,作者还实现了氧化还原活性酯的光催化官能团化(Table 3B)。研究发现,该体系可高效进行Giese-型反应,并成功与不饱和酮(7a)、烯丙基溴(7b)及砜(7c)进行反应,实现了烷基、烯丙基及炔基单元的引入。基于光氧化还原催化自由基-极性交叉机理的SN1型氟化、芳基化或烷氧基化反应均未成功,且体系中水分子发生亲核进攻生成醛类副产物7d。令人兴奋的是,在镍催化条件下可实现硼化反应,高效构建苄位有机硼化合物7e。遗憾的是,镍/铁双重金属催化体系结合有机锌试剂或有机镁试剂对底物6c与6d进行芳基化的尝试均未成功。
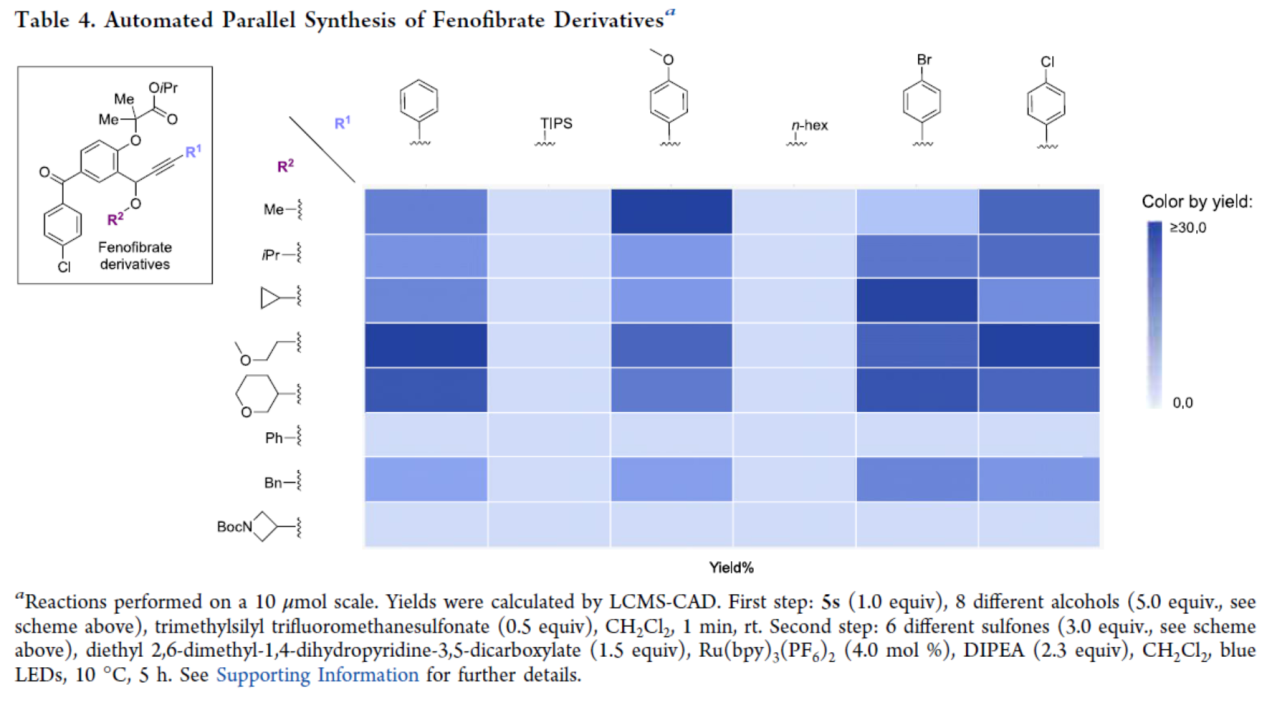
最后,作者探索了原子碳试剂在自动化平行合成中的应用,通过一锅法依次进行O-H插入反应与炔基化反应,成功制备了48种非诺贝特(Fenofibrate)衍生物(Table 4)。
(图片来源:J. Am. Chem. Soc.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn