

(图片来源:Nature)
正文
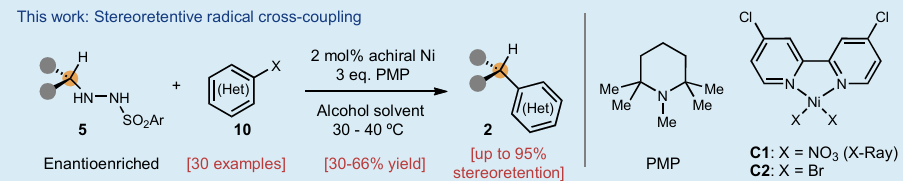
虽然自由基物种由Gomberg于120余年前发现,但自由基交叉偶联反应则是由Kochi在20世纪70年代首次实现的。与化学家们广泛应用的极性交叉偶联反应(如Suzuki、Negishi、Kumada等反应)构建C(sp2)-C(sp2)键不同,自由基交叉偶联在饱和体系的偶联中具有显著优势,其温和的反应条件及单电子化学特有的高化学选择性使其成为理想选择。事实上,利用普遍存在的碳基片段(如羧酸、醇、胺、烯烃等)进行交叉偶联可以极大简化复杂分子的合成路径。然而,尽管其具有这些优势,但涉及自由基的对映专一性偶联反应至今未有报道。由于自由基在瞬间即会发生外消旋化,因此这类反应被普遍认为极具挑战性。目前,仅能通过以下两种方式控制自由基交叉偶联的立体化学结果:1)使用手性配体进行调控;2)使用邻近立体中心的诱导实现非对映选择性控制。最近,美国斯克里普斯研究所Phil S. Baran课题组首次通过简单易得的对映富集磺酰肼化合物与廉价非手性镍催化剂组合,成功解决了这一长期难题。该方法无需外源氧化还原试剂或手性配体,即可实现对映体富集的烷基片段与(杂)芳基卤化物的立体保持对映专一性自由基交叉偶联反应(Figure 1)。欢迎下载化学加APP到手机桌面,合成化学产业资源聚合服务平台。
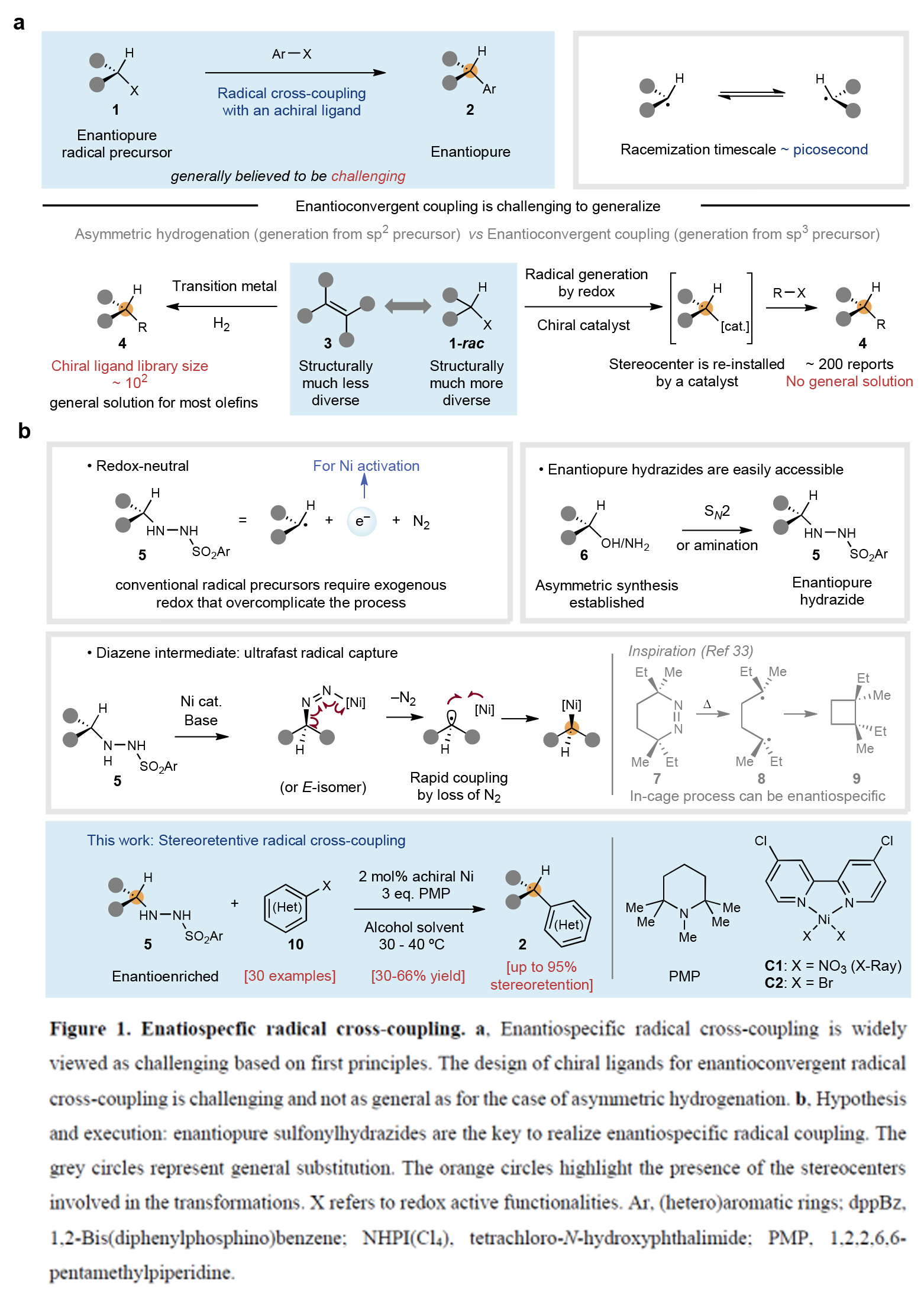
(图片来源:Nature)
首先,作者以对映体富集的磺酰肼11和碘吡啶12作为模板底物对此转化进行探索。通过一系列条件筛选,作者发现当使用条件A或条件B时,使用对映体比例为97.5:2.5的磺酰肼11为原料,可以46-55%的产率获得产物13,产物的对映体比例分别为92.5:7.5或93.6:6.4(即对映选择性保持率分别为89%或92%)(条件A:2 mol% C1, PMP (3.0 equiv), t-amyl alcohol (0.2 M);条件B:5 mol% C2, PMP (3.0 equiv), carveol (0.2 M))。作者通过将Cbz保护基替换为Ts基团后进行X-射线晶体学分析,确认了产物的绝对构型(立体构型保持)。这两组最终优化的反应条件极为简便且相似:使用廉价的醇类作为溶剂(浓度0.2 M),简单的叔胺碱,温和加热条件,以及2-5 mol%负载量的廉价镍催化剂(Figure 2a)。
在得到了最优反应条件后,作者对此转化的底物范围进行了考察(Figure 2b)。实验结果表明一系列不同的环骨架,如吡啶、嘧啶、哒嗪、吡啶酮、芳烃等均可兼容。此外,一系列不同的吸电子基、给电子基以及卤原子同样可兼容此转化。值得注意的是,含邻位取代基的底物以及游离的苯胺均可实现转化。总体来讲,该转化具有良好的底物适用性和官能团兼容性,以30-57%的产率,良好的对映选择性得到相应的产物16-41。
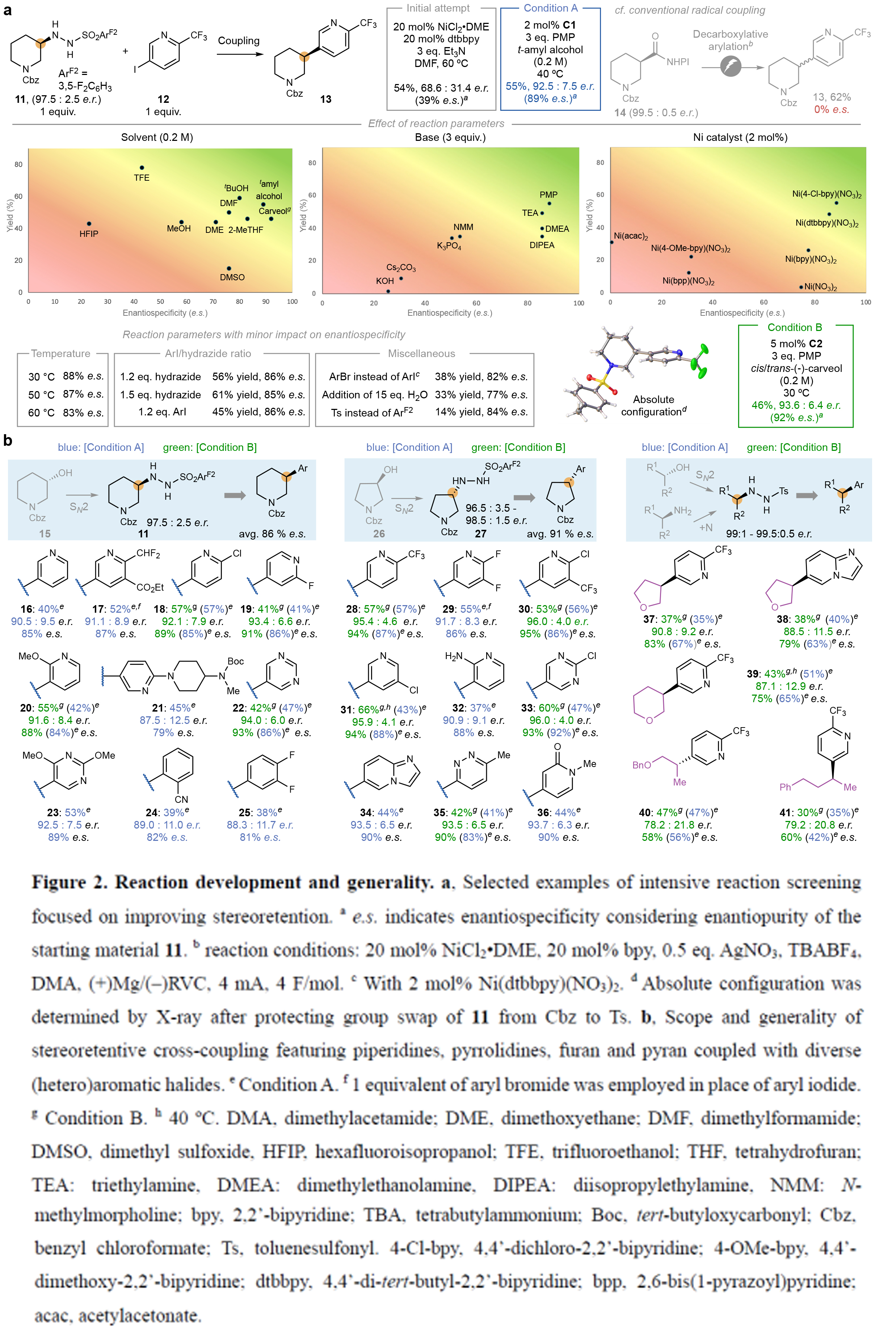
(图片来源:Nature)
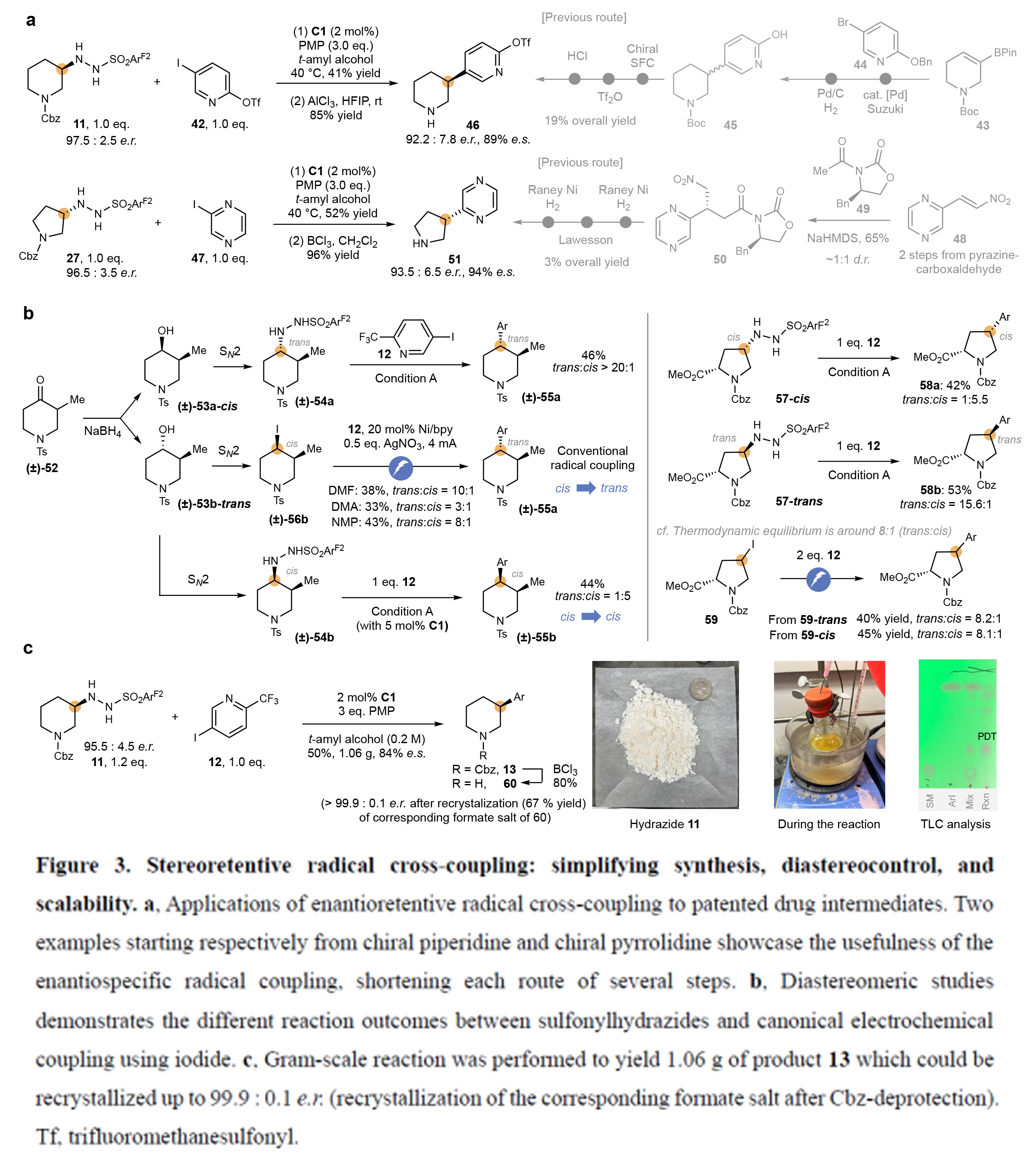
为了证明此转化的实用性,作者以利用11和42作为起始原料,利用此策略可以以两步(41%,85%)35%的总产率得到手性哌啶产物46(95.2:7.8 er; 89% e.s.)。而文献报道的合成路径则需要五步,仅以19%的总产率得到46(Figure3a)。此外,当利用27和47作为起始原料,利用此策略可以以两步(52%,96%)得到手性哌啶产物51(93.5:6.5 er; 94% e.s.)。这与文献报道的需要六步3%的总收率相比具有较大的优势。
随后,作者通过考察非对映选择性控制进一步探究了该反应的立体保持特性(Figure3b)。现有文献充分证实,自由基交叉偶联会重置反应中心的立体构型,其立体化学结果由预先存在的立体中心所决定。基于此,作者将外消旋哌啶酮52经NaBH4还原得到醇53(反式/顺式=3:1)。其中顺式异构体53a转化为相应的反式磺酰肼54a,与底物12偶联后以20:1的选择性得到反式构型哌啶55a。值得注意的是,由反式醇53b制备的顺式碘化物56b,在三种不同溶剂中进行常规电催化自由基交叉偶联条件时,仍主要生成反式产物55a。与之形成鲜明对比的是,反式醇53b可转化为保持顺式构型的磺酰肼54b,最终以5:1的非对映选择性(硅胶柱层析易分离)获得顺式主产物55b。类似地,3-羟基脯氨酸衍生的顺/反式磺酰肼57与12进行偶联时,分别以立体保持的方式得到顺式加合物58a(反/顺=1:5.5)和反式加合物58b(反/顺=15.6:1)。作为对照实验,作者采用经典电催化自由基偶联条件时,无论使用顺式或反式碘化物59与12反应,均主要生成反式加合物58(反/顺=8.1-8.2:1)。
接下来,作者通过克级规模实验验证了该反应的实用性(Figure3c)。作者以磺酰肼11和芳基碘化物12为原料制备哌啶13。在不改变标准反应条件的情况下,偶联反应顺利进行,以50%的分离收率和84%的对映选择性(e.s.)获得加合物13。鉴于工艺化学中已知对映体富集物质可通过重结晶纯化,作者脱除Cbz保护基后,仅经过一轮重结晶即可获得脱保护哌啶产物,其立体纯度提升至>99.9:0.1 e.r.。
(图片来源:Nature)
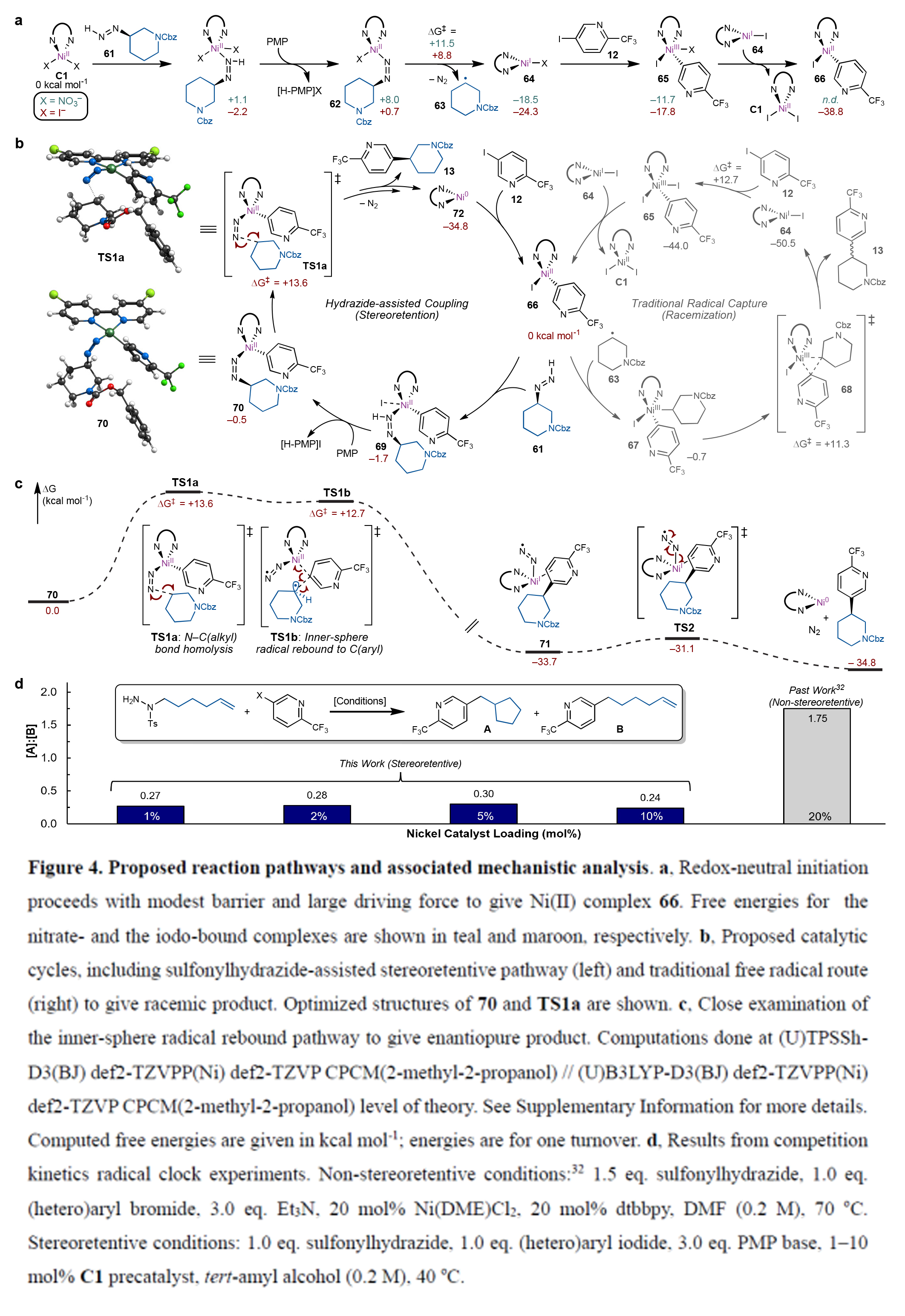
最后,作者对此过程进行了机理探索(Figure4)。作者通过DFT计算,得出此反应通过一种独特的含二氮烯镍过渡态进行,其C-C键的形成由N2的释放来驱动。此外,作者通过控制实验得出该反应是通过内球自由基交叉偶联机制实现了立体构型保持,这一机制成功规避了传统镍(II)催化体系形成C(sp2)-C(sp3)键时所面临的热力学障碍。
(图片来源:Nature)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn