


研究背景
环胺类化合物,特别是氮杂环丁烷、哌啶、吡咯烷和氮杂环庚烷,因其独特的结构特征和广泛的生物活性,已成为制药和农用化学品领域的核心骨架分子。这一重要性在美国食品药品监督管理局(FDA)最新批准的小分子药物数据库中得到充分印证。环胺合成化学的发展对创新药物研发具有重要推动作用。尽管过去几十年已开发出许多高效合成方法,但现有技术大多局限于特定结构类型的环胺。值得注意的是,不同环尺寸(尤其是4~7元环)的构建往往需要差异化的底物设计和截然不同的合成路线,这已成为制约药物发现效率的重要因素(图1a,左)。
另外,在现代药物研发中,增加候选药物分子中sp³杂化碳原子比例(Fsp³)已成为重要趋势。这种结构特征不仅能显著提升先导化合物的生物活性,还可有效降低临床研发过程中的淘汰率。从分子设计角度看,引入环烷烃结构不仅能提高Fsp³值,还能增加分子的三维复杂性,为取代基的精细调控提供更多可能,同时保持分子刚性和代谢稳定性等 (图1a,右)。
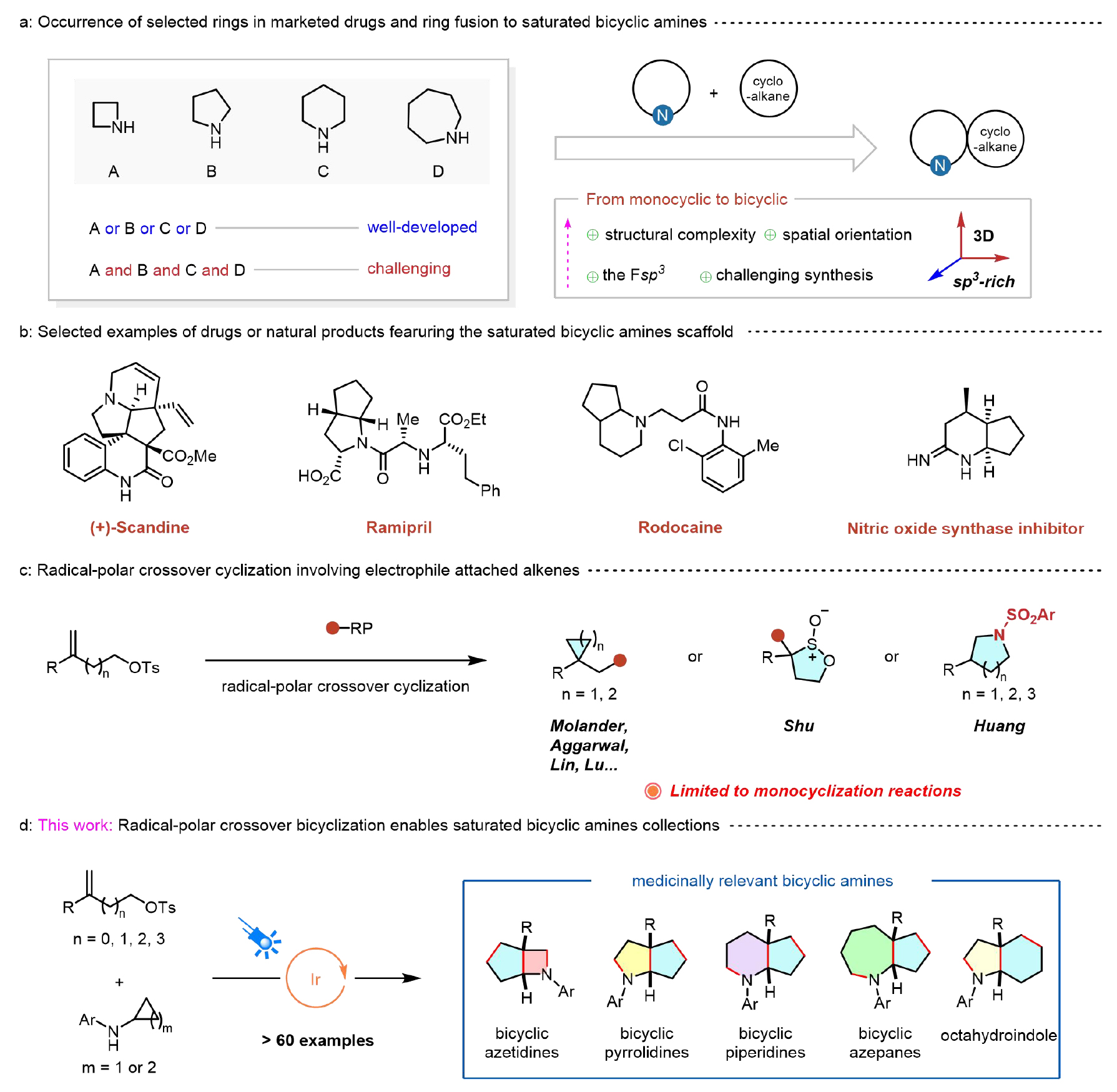
图1. 饱和双环胺的重要性及合成方法介绍
环戊烷并环胺作为一类重要的双环胺衍生物,因其独特的结构和理化性质,在众多天然产物和药物分子中广泛存在(图1b)。这类双环体系的传统合成方法主要包括氢化、重排、环化和环加成等策略。尽管取得了上述进展,但这些方法通常需要预先构建的单环或双环结构作为底物,导致合成效率低下且步骤繁琐。因此,更高效的双环化反应亟待发展!最近,可见光驱动的分子内自由基环化(aza Paternò-Büchi反应)为饱和双环氮杂环丁烷的合成提供了新思路。该方法可直接构建双环骨架,避免了传统方法对预成型环状底物的依赖。然而,该方法仅适用于[2+2]环化反应,难以实现环尺寸的灵活调控。
近年来,自由基-极性交叉环化(RPCC)反应受到了广泛关注,特别是Molander、Aggarwal、Shu、Huang、Lin和Lu等课题组开发的一系列创新方法,实现了温和条件下从取代烯烃出发合成饱和碳环和杂环化合物。作者设想:若能实现取代烯烃与N-芳基环丙胺之间的自由基-极性交叉双环化反应,将为构建不同环尺寸的双环胺化合物库提供重要合成工具。但这一设想面临两大挑战:(1)环丙胺的1,3-双官能团化反应较为常见,而更具合成价值的三官能团化反应却鲜有报道,极具挑战性;(2)环化反应通常需要精确控制反应位点间距,开发一种普适性的方法来实现不同尺寸(特别是中小环系)环胺的合成仍面临巨大挑战。本研究,作者报道了一种光诱导自由基-极性交叉双环化反应,实现了环丙胺与取代烯烃的高效转化(图1d)。这种自由基-极性交叉双环化策略为饱和双环胺的从头合成提供了便捷途径。特别值得注意的是,该方法采用相同的底物设计和相同的合成路线,以模块化的方式高效构建具有重要药用价值的4/5-、5/5-、6/5-、7/5-和5/6-并环饱和双环胺,并表现出优异的立体选择性。
研究内容
条件筛选
作者以环丙胺(1a)和取代烯烃(2a)作为模型底物开始反应条件的优化研究(表1)。实验结果表明,在450-455 nm蓝光LED照射24小时条件下,以Ir(dtbbpy)(ppy)2PF6(1 mol%)为光催化剂,K2HPO4(50 mol%)为碱,PhCl(0.1 M)为溶剂体系,可以81%的分离收率获得目标产物3,且表现出优异的非对映选择性(表1,entry 1)。值得注意的是,溶剂效应对反应活性和选择性具有显著影响:卤代苯类溶剂(PhCl和PhF)表现出最佳反应效果,而PhMe、DMF和DMA等溶剂则导致产物收率明显降低(entries 1-5)。在光催化剂筛选实验中,fac-Ir(ppy)3、Ru(dbz)3(ppy)2和4CzIPN等光催化剂均表现出不同程度的催化效率下降(entries 6-8)。碱用量研究表明,K2HPO4用量增加或减少均会导致产物收率降低(entry 9)。采用2a'、2a''和2a'''替代2a时,产物3的分离收率分别为53%、68%和66%(entry 10)。值得注意的是,该反应对氧气敏感,在空气氛围下完全抑制了反应进行(entry 11)。进一步的控制实验证实,可见光和光催化剂均为该转化反应的必要条件(entries 12-13)。
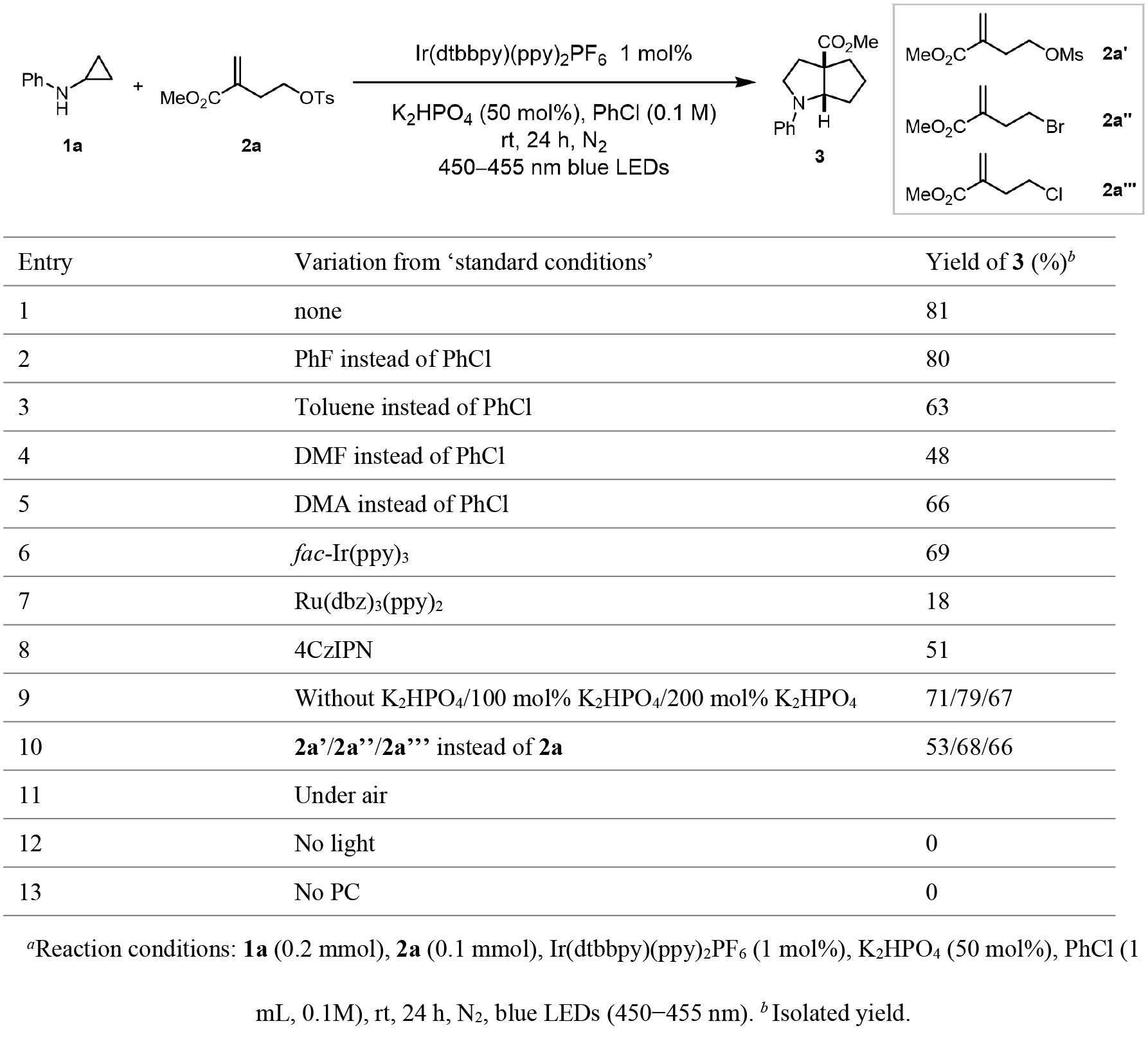
表1. 条件筛选
底物范围
在最优反应条件下,作者继续探究了该反应的底物适用范围。如表2所示,首先系统考察了不同取代基修饰的环丙胺类底物的适用范围。实验结果表明,芳环上带有不同电子效应取代基(包括供电子基团如甲基、正丁基、叔丁基二甲基硅氧基、甲氧基、乙氧基、二甲基等,以及吸电子卤素如氟、氯、碘)的环丙胺均能顺利参与反应,以中等至良好的收率(47–82%)获得目标产物(4–16)。特别值得注意的是,含三氟甲氧基(17)和三氟甲基(18)类药物优势结构的底物表现出优异的反应性,分别以67%和81%的收率获得相应产物。此外,4-苯基取代(19,72%)、萘基取代(20,55%;21,35%)以及含苯并呋喃"优势骨架"(22)的环丙胺类底物均展现出良好的兼容性。
在烯烃底物适用范围研究方面,多种官能团化烯烃(1b–1r)均能高效参与转化。其中,不同酯基取代的烯烃(1b–1f)以64–83%的收率生成相应双环吡咯烷产物(23–27)。值得注意的是,含氰基(1o)、酰基(1p)、羰基(1q)和硝基(1r)等活性官能团的芳基烯烃(1g–1r)同样适用,以中等收率(52–78%)获得目标产物(28–39),这为后续结构修饰提供了丰富可能。
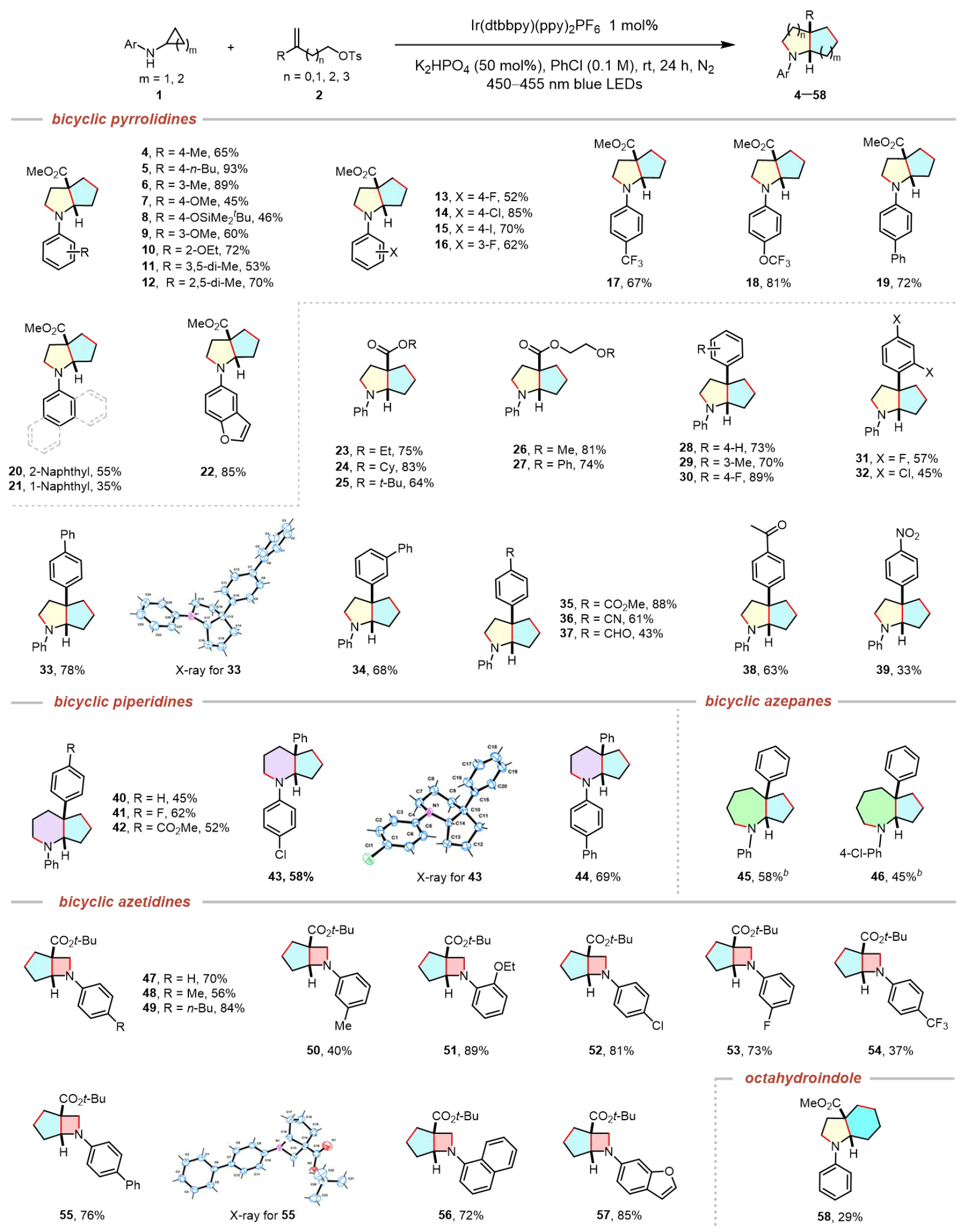
图2. 底物适用性探究
为进一步拓展该方法的应用范围,作者通过改变取代烯烃链长度实现了不同环系尺寸的精准调控。实验结果表明,该策略对双环哌啶类化合物(40–44)的合成具有显著普适性。经反应条件微调后,也能以中等收率获得双环氮杂庚烷(45,46)。特别值得关注的是,在药物研发领域,氮杂环丁烷作为一类小分子杂环化合物,因其相较于常见的五元、六元和七元环胺类化合物展现出更优异的药代动力学特性而备受关注。然而,传统适用于其他尺寸环胺合成的成熟方法在构建氮杂环丁烷骨架时往往表现不佳。该研究通过缩短取代烯烃的烷基链长,在最优条件下成功实现了取代烯烃2x与各种N-芳基环丙胺类化合物的高效反应,以良好至优异的收率获得目标双环氮杂环丁烷产物(47–57)。此外,N-苯基环丁胺作为底物也展现出一定的反应活性,能够以29%的分离收率获得八氢吲哚产物58。尽管该收率相对较低,但这一结果充分证明该反应体系能够兼容环丁烷这一稍大环系的骨架构建。
合成应用
基于前期广泛的底物适用性研究结果,作者进一步探究了该双环化反应的实用价值。实验表明,多种生物活性分子(包括洛索洛芬、3-吲哚乙酸、芬布芬、伊索克酸和舒巴坦)衍生的烯烃类底物,以及(-)-薄荷醇衍生的共轭烯烃,均能顺利参与反应,以中等至良好的收率(52–78%)获得目标产物59–65(图3a)。值得关注的是,该反应在放大至3.0 mmol规模时仍能保持稳定的收率(图3b)。通过NaBH4还原产物3,可以85%的高收率获得环烷醇衍生物66(图3c左)。此外,该方法可高效实现非布司他和吲哚美辛等药物分子与66的偶联(图3c右),充分展现了其在药物修饰中的应用潜力。此外,通过选择性脱除PMP保护基,可以66%的收率获得产物69(图3d),为后续结构衍生化提供了便利。
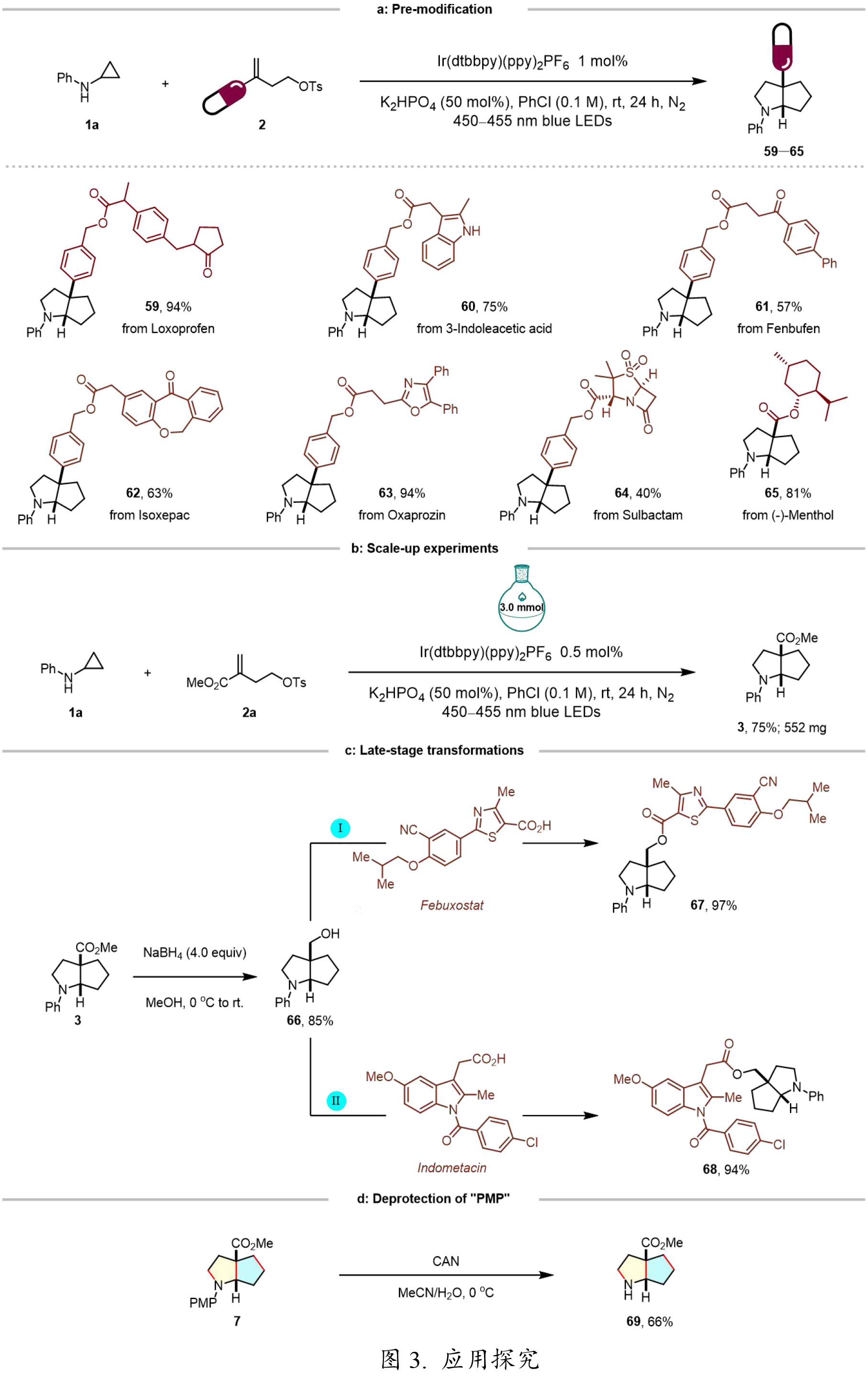
图3. 应用探究
机理研究
为了更好地了解反应机理,作者开展了一系列控制实验(图4)。自由基捕获实验表明,当加入2,2,6,6-四甲基哌啶-1-氧基(TEMPO)或丁基羟基甲苯(BHT)时,完全抑制了目标产物3的生成,同时通过高分辨质谱(HRMS)检测到相应的TEMPO/BHT加合物(图4A, B),这证实了反应过程中经历了自由基中间体。为进一步验证双环化反应的历程,作者设计了两组关键对照实验:在无光照和光催化剂的条件下,反应体系未能生成亲核取代产物3a(图4C);而环丙胺1a与4-羟基-2-亚甲基丁酸乙酯(2b')可发生[3+2]环化反应生成产物70(图4D),这一结果表明自由基环化过程可能是该转化的起始步骤。
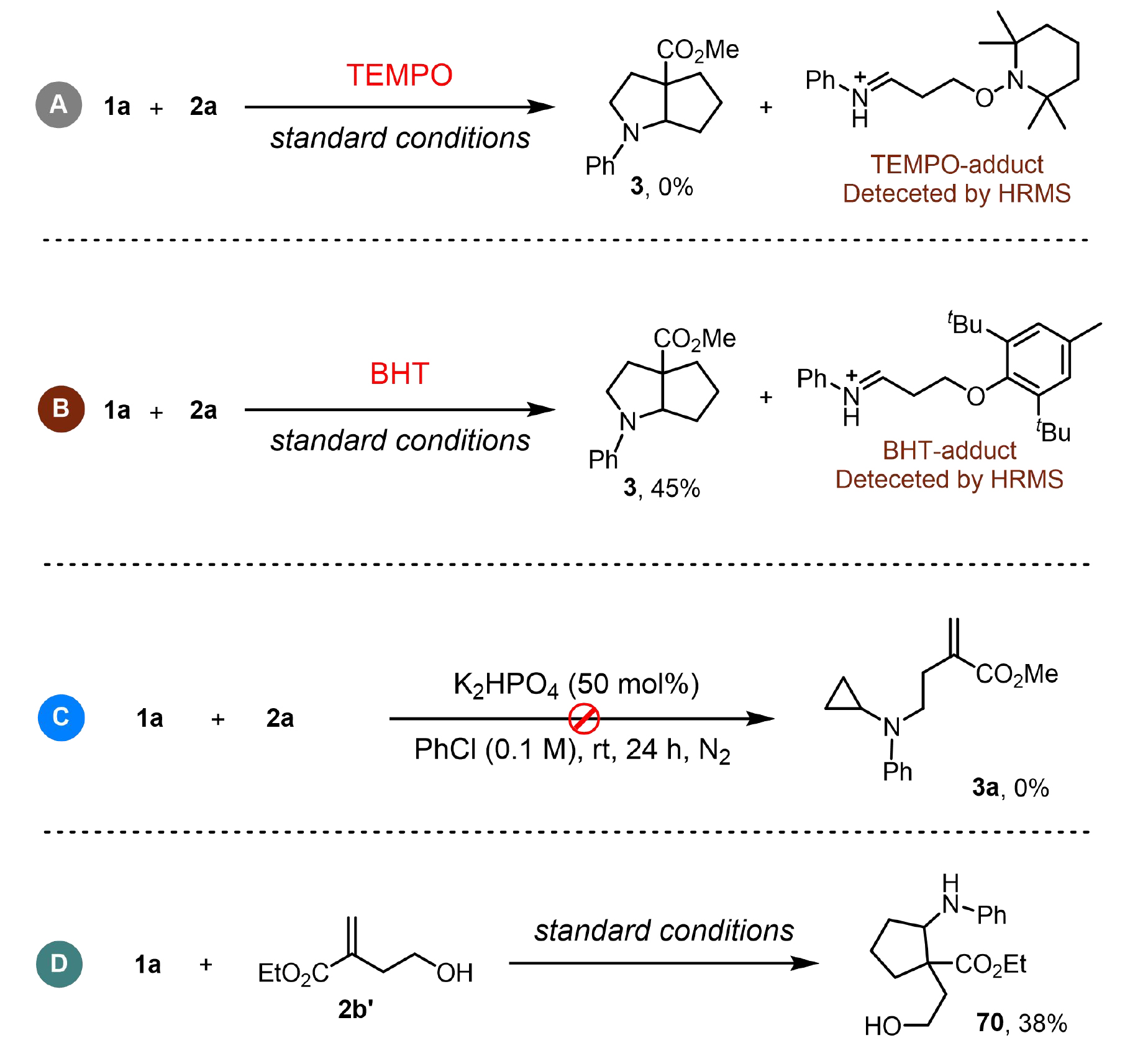
图4. 控制实验
基于上述机理研究及文献报道,作者提出如图5所示的可能反应机理:首先,光激发Ir(dtbbpy)(ppy)₂PF₆ (IrIII)产生激发态光催化剂Ir(dtbbpy)(ppy)₂PF₆* (IrIII*)。随后,IrIII*与N-芳基环丙胺发生单电子转移(SET)过程,使光催化剂被还原为IrII,同时N-芳基环丙胺被氧化为自由基阳离子中间体I。该中间体I通过开环过程转化为烷基自由基物种II。接着,II与取代烯烃2发生自由基加成反应,形成自由基中心位于叔碳位的自由基阳离子III。随后,III经过自由基环化反应生成自由基阳离子IV。中间体IV与光催化剂(IrII)发生第二次SET完成光氧化还原催化循环,并产生中间体V。最后,通过4、5、6或7-exo-tet环化反应生成饱和双环胺类产物。
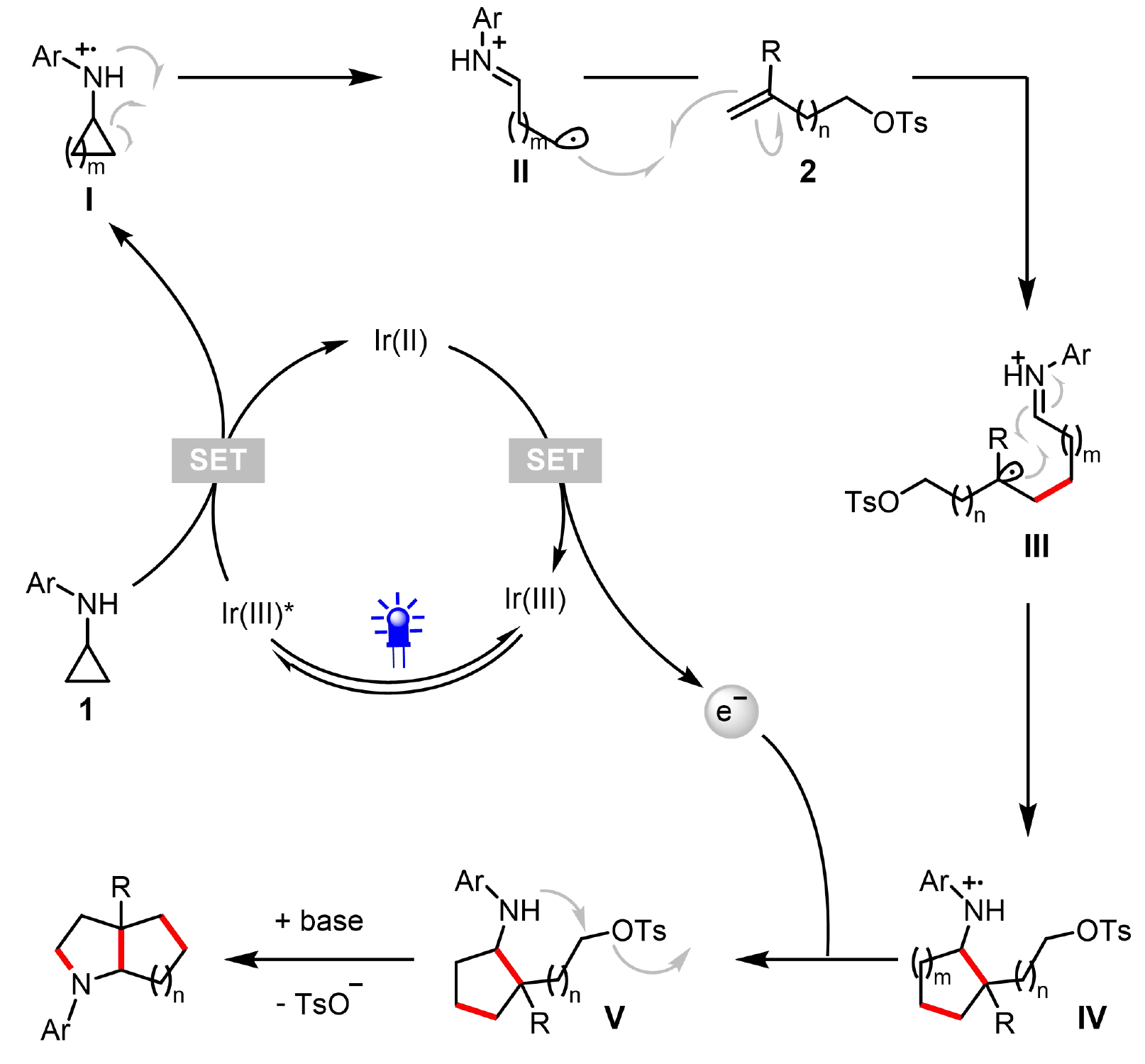
图5. 推测的机理
总结
综上所述,耿肖/王磊团队创新性地将光氧化还原催化与自由基-极性交叉环化(RPCC)过程相结合,开发了一种普适性的双环化策略,实现了以简单易得的环丙胺和取代烯烃为原料,高效、模块化地合成多种饱和双环胺类化合物。这一模块化合成方法具有以下显著优势:
1.通过简单调节链长度,可系统构建4~7元双环胺化合物,显著提高结构多样性,并展现出优异的非对映选择性和广泛的官能团兼容性。
2.实现了环丙胺的三官能团化反应(开环、双键加成、环化),拓展了该明星分子的反应模式。
3.所得饱和双环胺具有高Fsp³值,符合现代药物设计“逃离平面性”的趋势,展现出重要的应用潜力。
未来,这一策略有望在天然产物全合成、药物结构优化和生物活性分子库构建中发挥重要作用,尤其为氮杂环丁烷等传统方法难以合成的小环体系提供了简便高效的制备途径。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn