- 首页
- 资讯
董广彬课题组Science:利用连续两次碳碳键活化实现羰基-硫交换
来源:化学加原创 2025-06-17
导读:近日,美国芝加哥大学(University of Chicago)董广彬课题组报道了一种两步法羰基-硫原子(CO-to-S)交换策略。作者通过合理设计得到了一种N'-烷基-肼酰胺(NAHA)试剂,先后通过不同机理两次形成前芳香中间体,从而实现酮类底物的两个α-C−C键的均裂。该过程由Ts-S-Ts试剂介导,通过分子间与分子内烷基自由基对中心硫原子的连续捕获完成。该方法具有广泛的底物适用性和优异的化学选择性,为从简单易得的酮类化合物构建含硫骨架提供了高效途径。文章链接DOI:10.1126/science.adx2723。
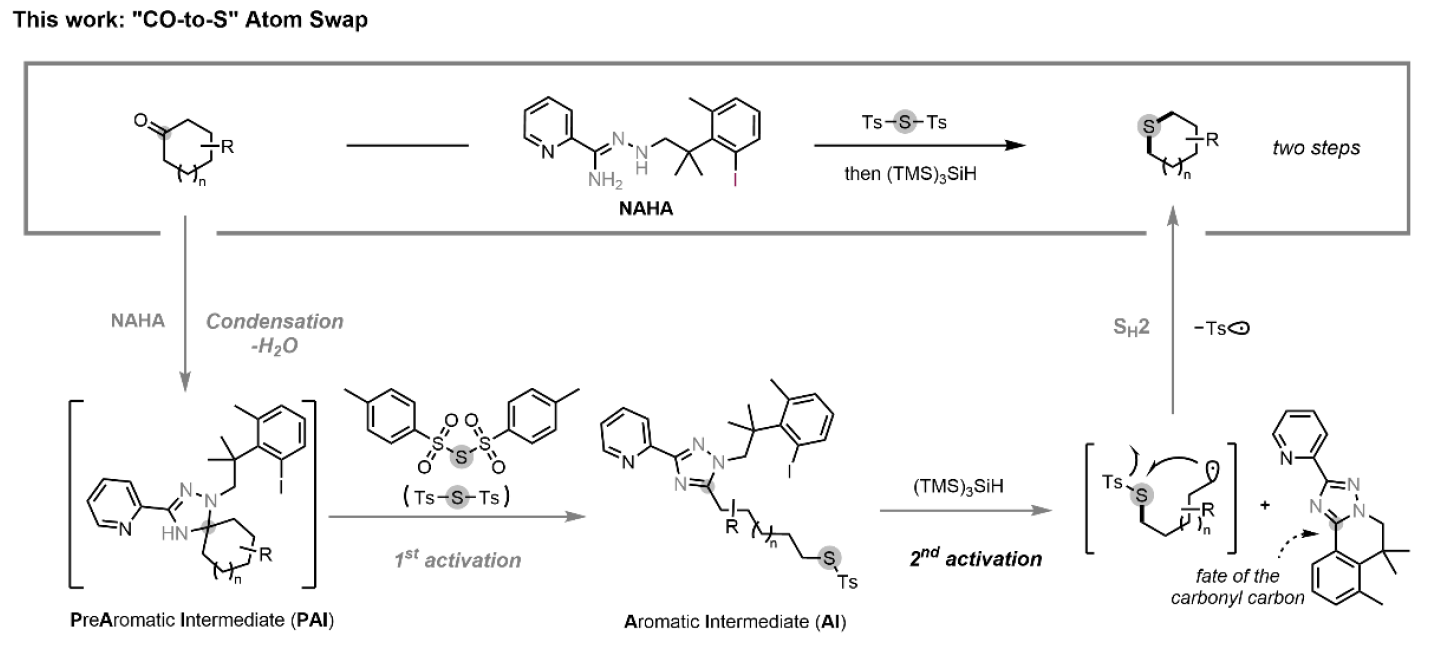
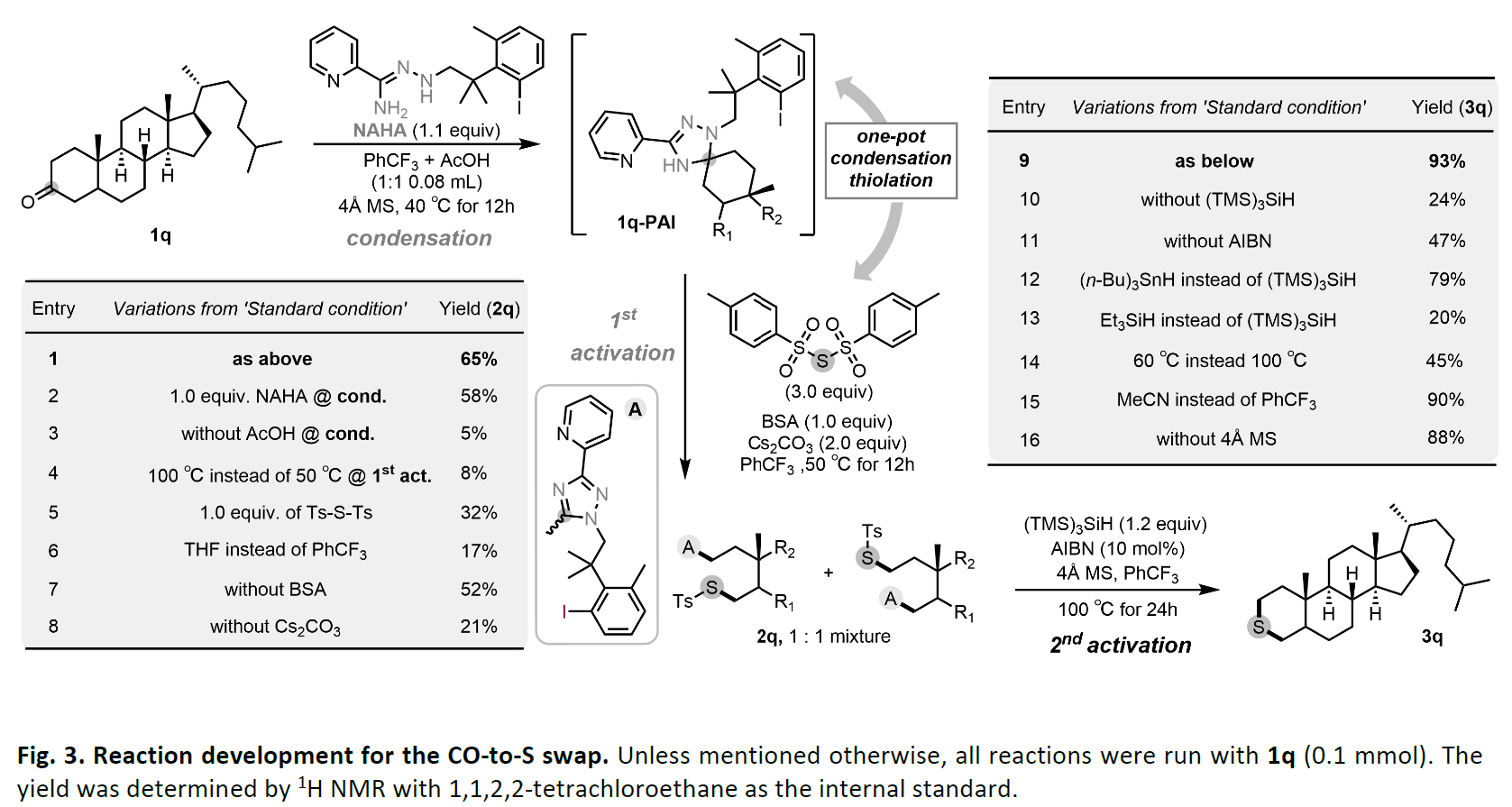
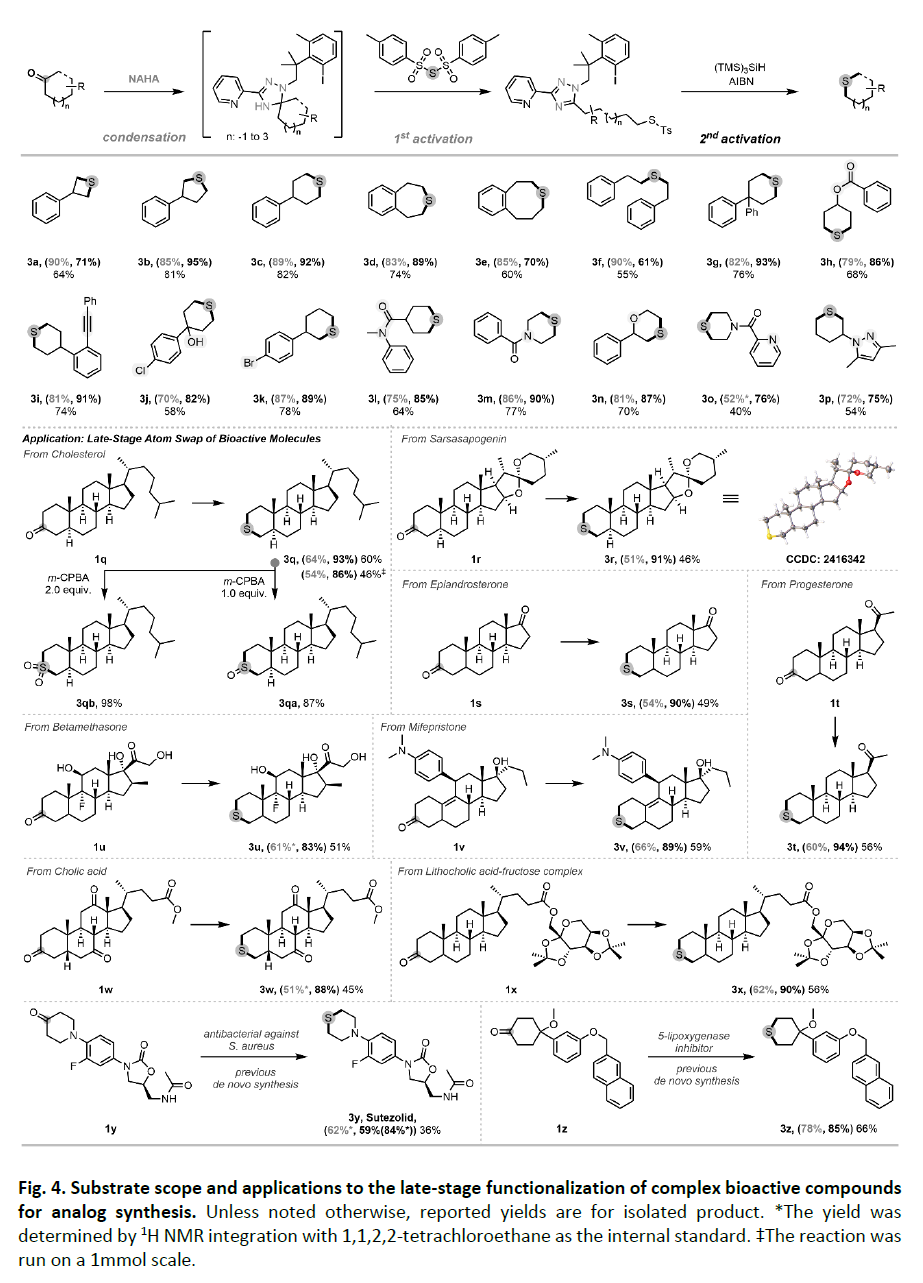
在药物研发中,将碳原子骨架替换为硫原子可获得具有优化性能的生物活性类似物。目前,硫代类似物几乎完全依赖从头合成,而现有的碳硫互换方法效率低下且需使用化学计量的汞试剂。近日,美国芝加哥大学董广彬课题组开发了一种基于合理设计的N'-烷基-肼酰胺(NAHA)试剂的直接羰基-硫原子置换策略,通过顺序双C−C键活化实现了碳硫原子交换。该策略底物适用性和化学选择性良好,为从酮类构建含硫骨架提供了新的途径(Fig. 1)。欢迎下载化学加APP到手机桌面,合成化学产业资源聚合服务平台。自2021年以来,董广彬课题组开发了一类以芳香化为驱动力、可断裂烷基酮C−C键的羰基活化试剂—N'-烷基-肼酰胺(NAHAs)(Fig.2A)。第一代NAHA试剂含N-甲基结构,能与酮类高效缩合形成前芳香中间体(PAI)。随后通过氢原子转移(HAT)或单电子转移(SET)触发芳香化驱动的C–C键断裂,产生烷基自由基。该自由基可被不同捕获剂捕获形成C−H、C−D、C−C或C−杂原子键,或被氧化为烯烃,从而实现直链酮的多种脱酰基转化。然而对于环状酮类,尽管C−C键断裂仍可发生,但生成的芳香副产物1,2,4-三唑片段会共价连接在开环产物上,导致反应终止。因此,实现CO-to-S转化的关键挑战在于如何活化第二个C−C键(即连接烷基与1,2,4-三唑的化学键)以实现进一步官能团化。受自由基介导的芳基转移反应最新进展的启发,作者假设可通过一类含芳基卤代的新型NAHA试剂实现烷基-三唑键的断裂。作者推测,在卤素原子转移(XAT)过程完成后(即通过硅或锡自由基物种夺取卤素原子后),生成的具有高活性的芳基自由基会通过分子内进攻三唑环,重新生成PAI自由基,进而促进烷基-三唑键的断裂,形成更稳定的烷基自由基。该自由基可进一步发生转化,并释放出基于三唑的三环副产物。随后,该烷基自由基可被首次活化过程中引入的官能团分子内捕获,实现原子交换,而脱除的羰基碳则保留在基于三唑的三环副产物中。为验证这一假设,作者选用连接有芳基溴基团的1,2,4-三唑化合物(1-ai)作为模板底物,研究第二次C-C键活化过程(Fig. 2B)。令人欣喜的是,在以偶氮二异丁腈(AIBN)为自由基引发剂、以(TMS)3SiH为XAT试剂及氢原子供体的情况下,烷基-三唑键确实可被断裂。鉴于芳基自由基与(TMS)3SiH之间的氢原子转移(HAT)速率常数高达108 M−1 s−1,该反应中观察到显著的Thorpe-Ingold效应。尽管简单的偕二甲基连接基团不足以抑制竞争性的HAT路径,但含有“三甲基锁”连接基团的类似物被发现能高效地以高选择性促进目标分子内环化反应。基于对C-C键活化机制的理解和NAHA试剂的设计原理,作者开发了CO-to-S转化反应(Fig. 3)。当以胆固醇衍生的酮1q为模板底物,作者发现带有三甲基锁结构的悬挂式芳基碘NAHA试剂效果最佳。在活化4Å分子筛存在下,1q与NAHA试剂于三氟甲苯/乙酸(1:1)混合溶剂中40oC反应可以接近定量的产率缩合。其关键突破在于高效硫原子转移(SAT)试剂的设计:该试剂需含两个硫基自由基离去基团,使中心硫原子能分步参与(1)第一次C-C键断裂后的分子间烷基自由基淬灭;(2)第二次C-C键断裂后的分子内环化。作者最终确定Ts-S-Ts为理想SAT试剂,因为Ts自由基不仅是SH2反应的优异离去基,还是已知的PAI断裂引发剂。实验证实,将粗产物1q-PAI与3.0当量Ts-S-Ts、1.0当量双(三甲基硅基)乙酰胺(BSA,除水剂)及2.0当量Cs2CO3在1 mL三氟甲苯中50oC反应12小时,可以以65%收率(两种异构体1:1)获得开环磺酰硫产物2q(entry 1)。随后,当作者将2q与1.2当量的(TMS)3SiH、10mol%的AIBN以及1.0当量的4Å分子筛在PhCF3中100oC反应24小时,可以以93%的产率得到产物3q(entry 9)。(TMS)3SiH的作用包括:i)该试剂生成的硅自由基可以从2q中夺取碘原子,形成相应的芳基自由基;ii)它能够淬灭Ts自由基,生成TsH并再生硅自由基,从而促进自由基链式反应的持续进行。在确立最优反应条件后,作者考察了两步法CO-to-S置换反应的底物适用范围(Fig. 4)。该转化不仅限于六元环硫醚的合成,四至八元环状硫醚(3a-3e)乃至直链结构(3f)均能以良好至优异收率获得(55-82%)。即使具有抗开环潜力的4,4-二取代底物(3g)也能顺利反应。此外,多种官能团如酯基(3h)、炔基(3i)、游离叔醇与氯代芳烃(3j)、溴代芳烃(3k)、酰胺(3l, 3m)、醚(3n)、吡啶(3o)和吡唑(3p)均展现出良好兼容性,产率为40-78%。基于优异的化学选择性,作者进一步探索了复杂生物活性分子的后期官能团化应用。除模板底物胆固醇衍生物(3q)外,天然产物衍生物如菝葜皂苷元(3r)、表雄酮(3s)、孕酮(3t)、倍他米松(3u)、米非司酮(3v)、胆酸(3w)和石胆酸(3x)均成功实现CO-to-S转化,产率为45-59%。当放大反应为1mmol规模时,3q的收率略有下降(46%)。该方法不仅兼容甾体复杂骨架,还能耐受缩酮(3r)、未保护的一/二/三级醇(3u)、胺基(3v)及烯烃(3v)等敏感基团。由于NAHA试剂与酮的缩合反应对位阻敏感,当底物含多个羰基时(1s,1t,1u,1w),反应优先发生在位阻较小的酮位点。针对大位阻酮类底物,硅基化NAHA试剂的开发正在进行。值得强调的是,硫醚可通过可控氧化便捷转化为亚砜(3qa)或砜(3qb),这使得该方法也能用于制备亚砜/砜类药用类似物。最后,作者利用该策略成功实现了从羰基前体直接合成苏特唑利(3y)和5-脂氧合酶抑制剂(3z),避免了从头合成。特别值得注意的是,合成苏特唑利过程中酰胺N-H键也能兼容该反应。董广彬课题组开发了一种两步法碳-硫原子交换(CO-to-S)策略,可实现酮类化合物向对应硫醚的高效转化。通过合理设计的双功能N'-烷基-肼酰胺(NAHA)试剂,实现了两阶段C−C键活化,从而完成碳骨架末端的顺序官能团化。该策略具有广泛的底物适用性、温和的氧化还原中性条件,以及高效和化学选择性自由基介导,特别适用于结构复杂生物活性分子的后期修饰。这类NAHA试剂独特的活化模式,有望成为未来sp3-碳富集有机分子骨架多样化修饰的通用策略。文献详情:
Carbonyl-to-sulfur swap enabled by sequential double carbon-carbon bond activation.
Zining Zhang and Guangbin Dong*.
Science,2025
https://www.science.org/doi/10.1126/science.adx2723.
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn