

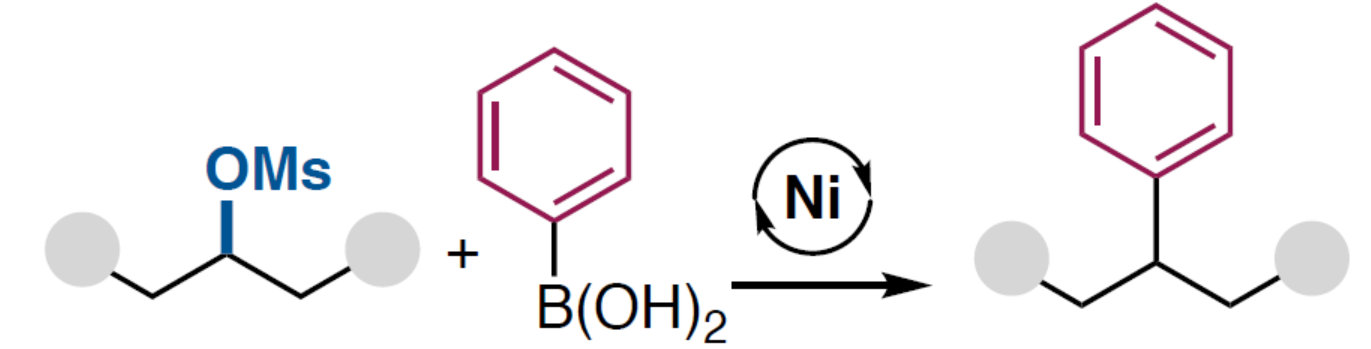
(图片来源:Angew. Chem. Int. Ed.)
正文
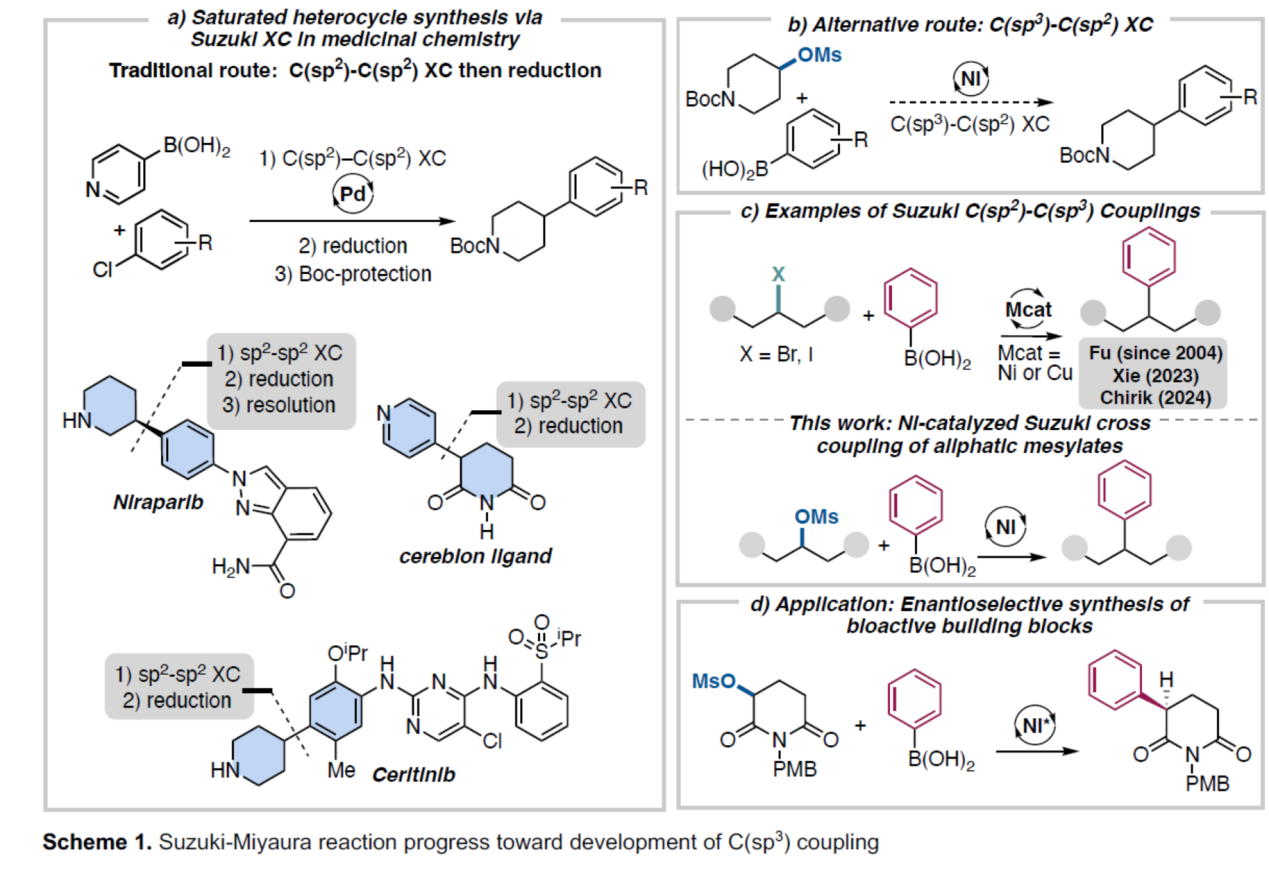
碳-碳键形成反应是构建药物分子、天然产物及农用化学品的关键合成手段。在众多的相关反应中,过渡金属催化交叉偶联(XC)与交叉亲电偶联(XEC)反应对合成化学领域产生了深远影响。其中,Suzuki-Miyaura交叉偶联反应作为一种高效且通用的策略,能够实现卤代物/拟卤代物与硼酸起始原料之间碳-碳键的精准构建。相较于其他过渡金属催化的偶联体系,该反应因硼酸底物易得、试剂操作简便及反应条件温和等优势而备受青睐。基于此,Suzuki-Miyaura反应在制药工业中广泛应用,并已成为多种药物分子中构建碳-碳键的核心方法。目前,大多数策略依赖于传统的联芳基偶联反应,但脂肪族亲电试剂偶联将提供更为直接的合成路径。例如,ALK抑制剂Ceritinib、PARP抑制剂Niraparib及cereblon配体等含氮药物分子,当前需通过C(sp2)−C(sp2)偶联,再通过部分还原为相应的饱和杂环化合物(Scheme 1a)。而直接采用取代哌啶的偶联策略在理论上更高效,但相关反应体系开发仍存在显著挑战(Scheme 1b)。
目前,用于C(sp2)−C(sp3)Suzuki-Miyaura反应的方法仅限于卤代物亲电试剂(Scheme 1b)。Jarvo团队设想,开发一种能够将脂肪醇衍生物的C-O键转化为C-C键的Suzuki-Miyaura交叉偶联反应具有重要价值,尤其在后期官能团化反应。相较于卤代物、胺类等其他偶联试剂,醇类化合物在商业上也更容易获得。然而,对于脂肪醇衍生物的XC及XEC反应,却较少有相关的研究报道。近日,美国加利福尼亚大学欧文分校Elizabeth R. Jarvo课题组报道了一种镍催化脂肪族磺酸酯与芳基硼酸的Suzuki-Miyaura交叉偶联反应(Scheme 1c)。同时,通过一锅法反应实现了醇类化合物的高效芳基化反应。此外,作者还开发了使用手性镍催化剂进行的立体汇聚不对称反应,高效合成了手性α-芳基/杂芳基戊二酰亚胺衍生物(Scheme 1d)。欢迎下载化学加APP到手机桌面,合成化学产业资源聚合服务平台。
(图片来源:Angew. Chem. Int. Ed.)
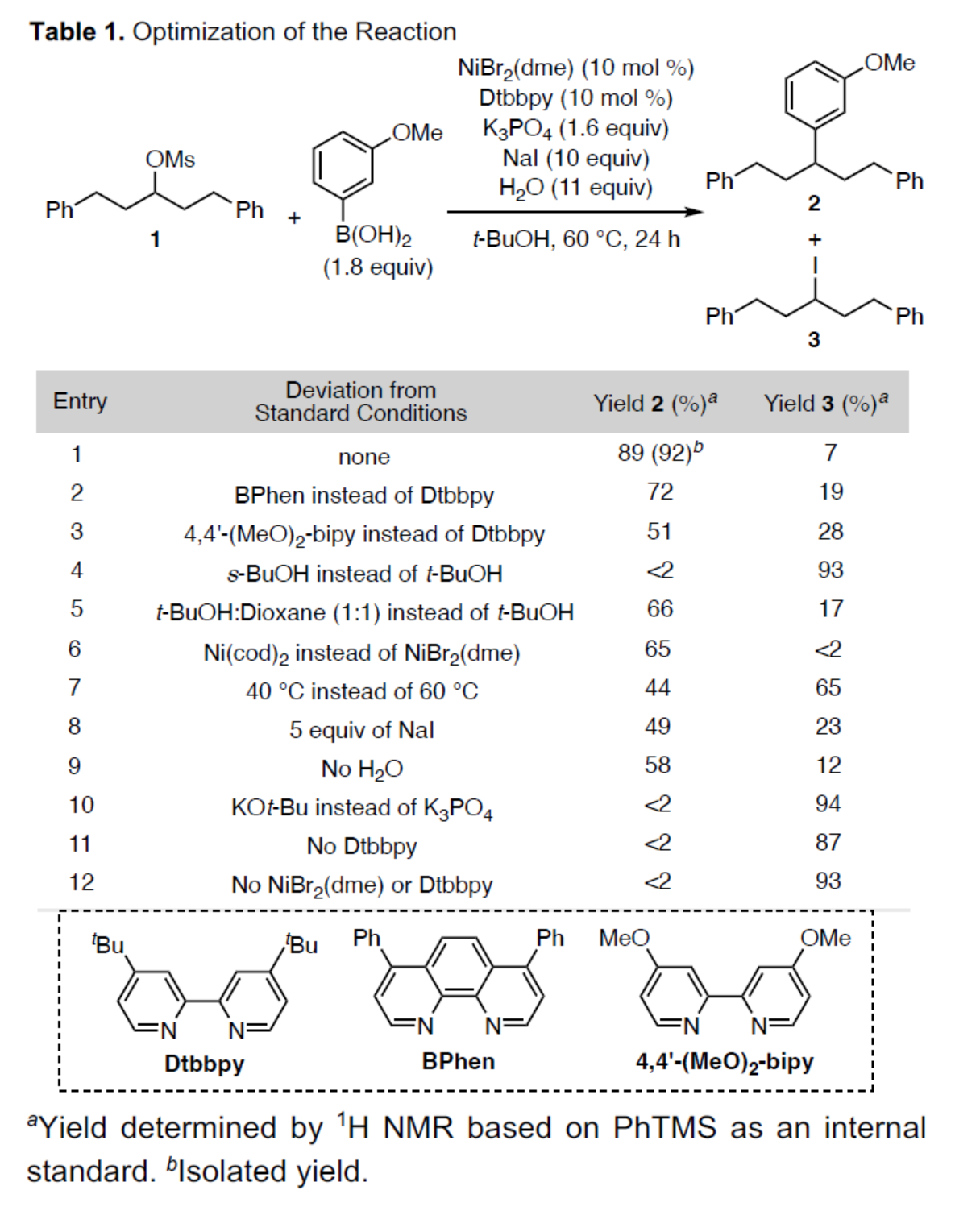
首先,作者以联芳基甲磺酸酯1a与3-甲氧基苯硼酸作为模型底物,进行了相关偶联反应条件的筛选(Table 1)。当以NiBr2(dme)(10 mol %)作为催化剂,Dtbbpy(10 mol %)作为配体,K3PO4(1.6 equiv)作为碱,NaI(10 equiv)与H2O(11 equiv)作为添加剂,在t-BuOH溶剂中60 ℃反应24 h,可以89%的收率得到产物2。
(图片来源:Angew. Chem. Int. Ed.)
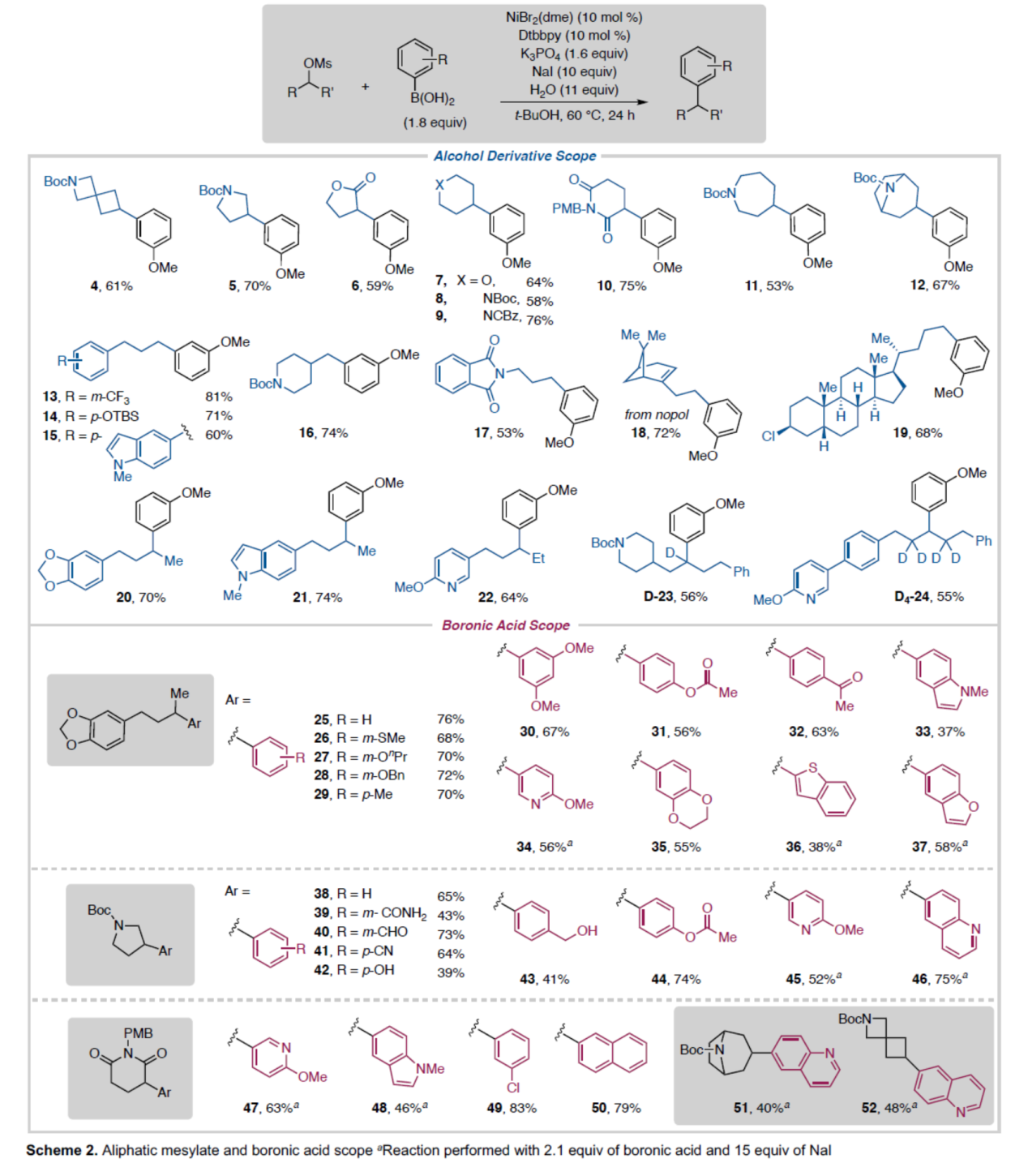
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Scheme 2)。首先,一系列四至七元环取代的甲磺酸酯,均可顺利反应,获得相应的产物4-12,收率为53-76%。当一级甲磺酸酯中含有不同电性取代的芳基、环烷基与杂环取代基,均可体系兼容,获得相应的产物13-17,收率为53-81%。值得注意的是,诺卜醇(18)以及含有烷基氯的石胆酸衍生物(19),均具有良好的耐受性。同时,含有苯并二氧杂环戊烯基、吲哚和吡啶取代的二级无环甲磺酸酯底物,也是合适的底物,获得相应的产物20-22,收率为64-74%。带有氘标记的甲磺酸酯,也成功进行偶联(D-23和D4-24),这可能适用于药物化学中的药代动力学研究。其次,一系列不同电性取代的芳基硼酸与杂芳基硼酸,均可顺利进行反应,获得相应的产物25-52,收率为37-83%。值得注意的是,一系列活性基团,如烷氧羰基、乙酰基、甲酰基、羟基等,均与体系兼容。
(图片来源:Angew. Chem. Int. Ed.)
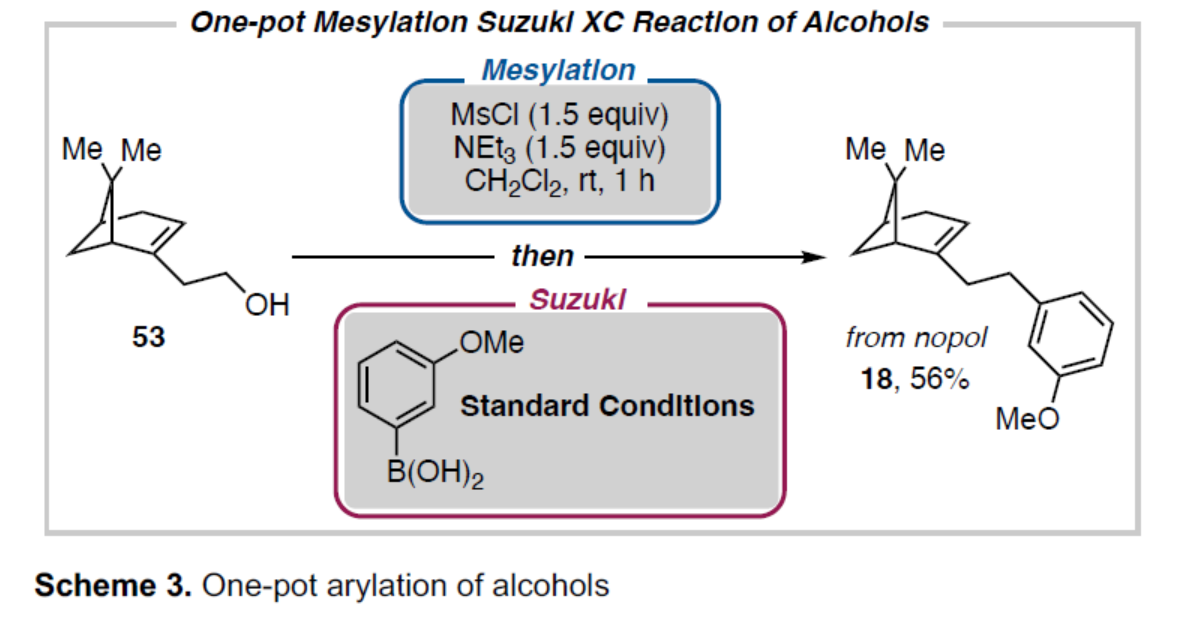
其次,作者以醇衍生物53为底物,通过甲磺酰化与Suzuki-Miyaura交叉偶联的一锅串联反应,可直接合成产物18,收率为56%,进一步证明了可在单反应容器中从简单且丰富的起始底物中直接获得多种芳基化产物(Scheme 3)。
(图片来源:Angew. Chem. Int. Ed.)
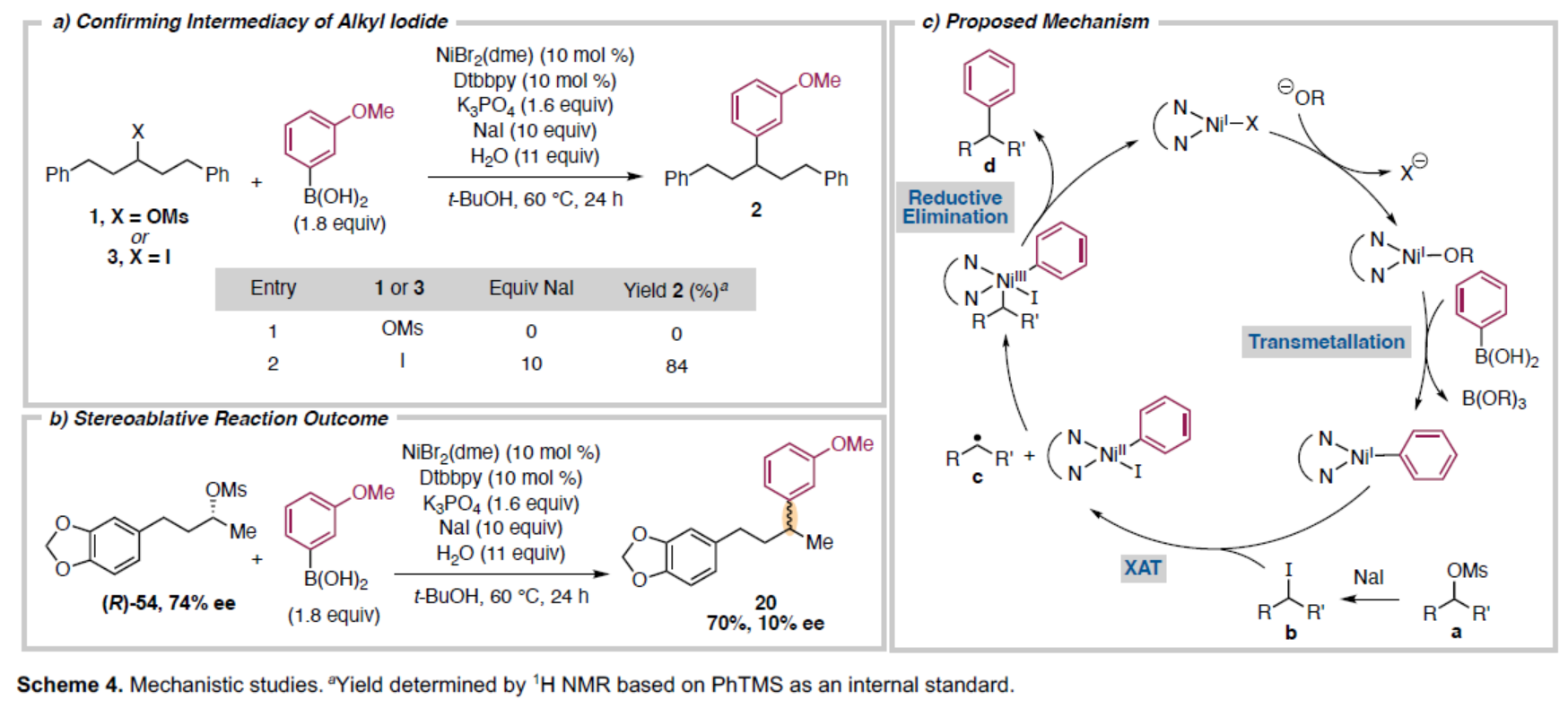
紧接着,作者还对反应机理进行了进一步的研究(Scheme 4)。首先,在甲磺酸酯1的反应中省略卤化物,会导致起始原料完全回收。同时,将碘化物3置于标准反应条件下,可生成芳基化产物,收率达84%。因此,反应涉及原位生成烷基碘化物的过程(Scheme 4a)。其次,在镍催化剂存在下,烷基碘化物通常经历氧化加成步骤,该过程通过卤素原子转移生成自由基中间体,导致二级碳中心发生立体消除结果。通过合成对映富集的甲磺酸酯(R)-54并进行XC反应,实验结果显示芳基化产物接近外消旋混合物,此现象与烷基自由基中间体的存在一致(Scheme 4b)。基于上述的研究以及相关文献的查阅,作者提出了一种合理的催化循环过程(Scheme 4c)。首先,硼酸与镍氧中间体经转金属化,生成芳基Ni(I)中间体。同时,甲磺酸酯a与NaI经置换反应,生成碘代烷烃b。其次,碘代物b通过XAT与Ni(I)中间体发生氧化加成,生成烷基自由基c。自由基c与Ni(II)配合物重组,生成有机镍(III)中间体,其经还原消除后,从而获得目标产物d。此机理与镍催化溴代烷烃Suzuki-Miyaura偶联中提出的镍(I)-(III)循环机理类似。此外,涉及自由基链或镍(0)催化剂氧化加成引发的路径亦具合理性。
(图片来源:Angew. Chem. Int. Ed.)
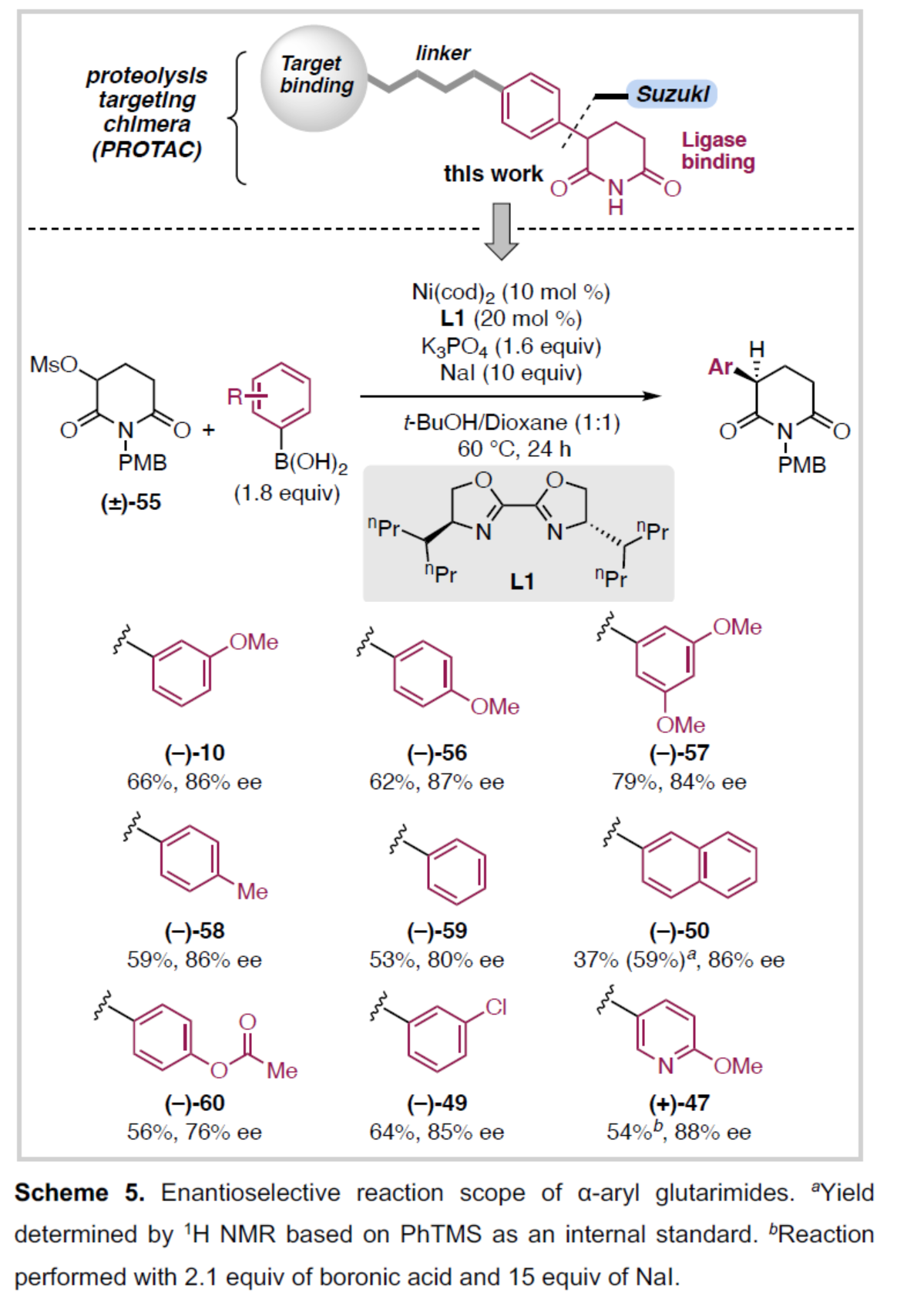
随后,通过对反应条件的优化后发现,当使用4-HeptyBiOx(L1)作为手性配体时,还可实现相应的对映选择性Suzuki-Miyaura交叉偶联反应(Scheme 5)。通过对底物范围的扩展时发现,当以外消旋甲磺酸酯55为底物,一系列不同取代的芳基硼酸与杂芳基硼酸,均可顺利进行反应,获得相应的手性α-芳基和杂芳基戊二酰亚胺衍生物,收率为37-79%,ee为76-88%。值得注意的是,一系列活性基团,如烷氧羰基与卤素,均与体系兼容。
(图片来源:Angew. Chem. Int. Ed.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn